Артериальная гипертония ремоделирование миокарда левого желудочка

Артериальная гипертензия (АГ) является главным фактором риска сердечно-сосудистой заболеваемости и смертности. Наличие АГ повышает риск развития ишемической болезни сердца (в том числе острого инфаркта миокарда и внезапной коронарной смерти) более чем в 2 раза, а возникновения сердечной недостаточности и инсульта – более чем в 3 раза.
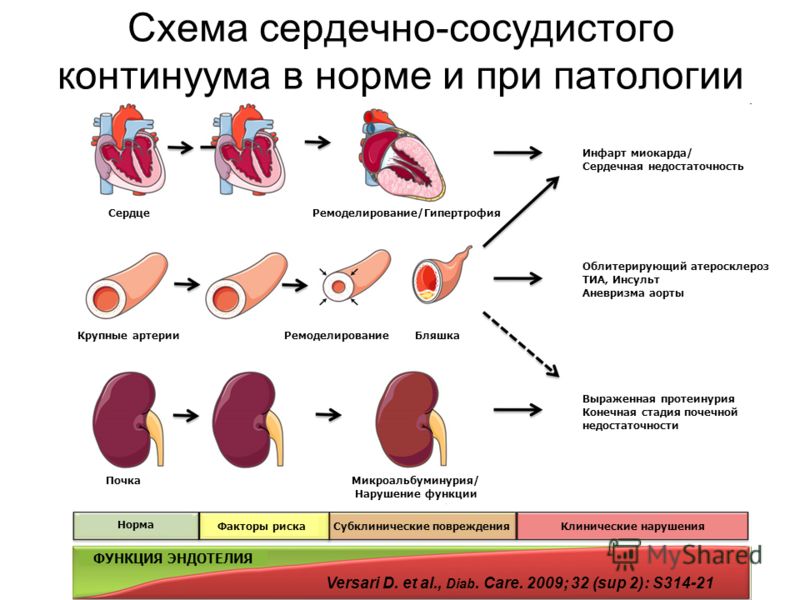
В последние годы внимание специалистов, исследующих эссенциальную АГ, обращено на ремоделирование сердечно-сосудистой системы при данном заболевании. Ремоделирование сердца представляет собой процесс комплексного нарушения его структуры и функции и включает увеличение массы миокарда, дилатацию полостей и изменение геометрической характеристики желудочков.
Исследования последних лет показали, что гипертрофия левого желудочка (ГЛЖ) является далеко не единственным вариантом развития гипертонического сердца. С совершенствованием эхокардиографической диагностики ГЛЖ и более углубленным изучением данной проблемы стало очевидно, что анатомические изменения левого желудочка при АГ не всегда сопровождаются нарастанием массы миокарда. Оказалось, что во многих случаях изменение геометрии левого желудочка, в частности уменьшение размеров его полости, происходит при нормальной массе миокарда.
Природа ремоделирования при эссенциальной АГ неоднородна; с одной стороны – это ответ на повреждающую перегрузку, с другой стороны, доказано, что ремоделирование – процесс, связанный с первичным и нейрогуморально опосредованным нарушением клеточного ионотранспорта. Среди гуморальных нарушений, участвующих в процессах ремоделирования, главная роль отводится патологической активации ренинангиотензиновой системы (РАС), симпатоадреналовой системы и гиперинсулинемии.
Морфологические изменения при АГ характеризуются постепенным изменением геометрии и массы миокарда. В процесс сердечного ремоделирования вовлекаются все виды клеток, присутствующие в миокарде: миоциты, интерстициальные клетки, сосудистый эндотелий и иммунные клетки. На ранних этапах патологической ГЛЖ увеличивается диаметр кардиомиоцитов, число миофибрилл и митохондрий и размеры ядер. В более поздних стадиях гипертрофии отмечают также некоторые изменения клеточной организации и формы кардиомиоцитов. Последняя фаза гипертрофии характеризуется утратой сократительных элементов и параллельного расположения саркомеров в кардиомиоцитах. Другой важный морфологический признак гипертонического сердца – увеличение содержания в миокарде коллагена и фиброзной ткани. Такие факторы, как ангиотензин II, эндотелин-1 и альдостерон, обладают эффектом пролиферации фибробластов. Происходит также ремоделирование коронарных резистивных сосудов с последующим развитием периваскулярного фиброза в интрамуральных коронарных артериях и артериолах вместе с утолщением их срединного слоя. Помимо контрактильных нарушений в кардиомиоцитах, интерстициального и периваскулярного фиброзов, гибель кардиомиоцитов (апоптоз) теперь рассматривают как один из возможных определяющих факторов, способствующих переходу от компенсированной стадии ГЛЖ к декомпенсированной.
Непропорциональный рост миокардиальных и соединительнотканных структур способствует нарушению сначала диастолической, а затем и систолической функции левого желудочка и развитию застойной сердечной недостаточности. Миокардиальный фиброз приводит к уменьшению коронарного резерва, что у больных АГ может наблюдаться и при интактных коронарных артериях. Нарушение миокардиальной перфузии происходит вследствие увеличения коронарного сосудистого сопротивления, уменьшения количества капилляров на грамм мышечной ткани, структурных изменений коронарных артерий, эндотелиальной дисфункции. Уменьшение коронарного резерва при ГЛЖ повышает чувствительность сердца к ишемии, когда увеличивается потребность миокарда в кислороде или снижается перфузионное давление. Наличием миокардиальной ишемии при гипертоническом сердце можно объяснить учащение случаев желудочковых аритмий, фибрилляции предсердий, инфарктов миокарда и внезапной коронарной смерти у больных АГ.
Наиболее распространенной классификацией типов ремоделирования левого желудочка при АГ является классификация A. Ganau (1992), которая основана на определении индекса массы миокарда левого желудочка (ИММЛЖ) и относительной толщины стенок (ОТС) этого желудочка. В зависимости от уровня ИММЛЖ и ОТС выделяют четыре различных типа геометрической адаптации левого желудочка к гипертензии:
1) концентрическая гипертрофия левого желудочка (увеличение ИММЛЖ и ОТС);
2) эксцентрическая гипертрофия (увеличение ИММЛЖ при нормальной ОТС);
3) концентрическое ремоделирование (увеличение ОТС при нормальном ИММЛЖ);
4) нормальная геометрия левого желудочка.
По наблюдениям A. Ganau и R. Devereux при обследовании 165 нелеченых больных, сравнимых по тяжести и длительности гипертонии, у 52% был выявлен нормальный тип геометрии ЛЖ, у 13% – концентрическое ремоделирование, у 27% – эксцентрическая ГЛЖ и лишь у 8% – концентрическая ГЛЖ. Частота обнаружения разных типов ремоделирования левого желудочка при АГ различной степени тяжести изучена недостаточно. По данным Е. Шляхто (1999), концентрические варианты ремоделирования чаще встречаются при умеренной АГ, чем при мягкой, в то время как нормальный тип геометрии и эксцентрическая ГЛЖ – при I стадии артериальной гипертонии (по классификации ВОЗ, 1993).
От типа ремоделирования левого желудочка при АГ зависит риск развития сердечно-сосудистых осложнений. Наименее благоприятной в плане прогноза является концентрическая ГЛЖ – вероятность возникновения сердечно-сосудистых заболеваний в течение 10 лет составляет 30%; далее следует эксцентрическая ГЛЖ – 25%; концентрическое ремоделирование – 25%; нормальный тип геометрии – 9%. Некоторые авторы связывают это с тем, что наибольшая масса левого желудочка наблюдается при концентрической ГЛЖ, следовательно, неблагоприятный прогноз обусловлен увеличением массы миокарда левого желудочка (ММЛЖ).
Известно, что наличие ГЛЖ, независимо от уровня артериального давления, является неблагоприятным прогностическим признаком. Фремингемское исследование показало, что у лиц от 35 до 64 лет с электрокардиографическими признаками ГЛЖ риск развития сердечно-сосудистых заболеваний в 3-6 раз выше, чем у лиц без ГЛЖ. Установлено, что увеличение ИММЛЖ на 50 г/м2 сопровождается повышением риска ишемической болезни сердца на 50%. Относительный риск смерти при увеличении ММЛЖ на 100 г возрастает в 2,1 раза, а при увеличении толщины задней стенки левого желудочка на 0,1 см – приблизительно в 7 раз.
По данным эхокардиографии (ЭхоКГ) наличие гипертрофии стенок левого желудочка регистрируют, если толщина межжелудочковой перегородки и/или задней стенки левого желудочка в конце диастолы превышает 1,1 см. Более точным признаком ГЛЖ является увеличенная ММЛЖ, которая рассчитывается по формуле R. Devereux и N. Reichek (1977):
ММЛЖ = 1,04 ([КДР + ТЗСЛЖ + ТМЖП]3 − [КДР]3) − 13,6,
где КДР – конечный диастолический размер, ТЗСЛЖ – толщина задней стенки левого желудочка, ТМЖП – толщина межжелудочковой перегородки, выраженные в сантиметрах.
Поскольку ММЛЖ в значительной степени зависит от пола, роста и массы тела, ее значение индексируют по отношению к площади поверхности тела. В настоящее время отсутствуют общепризнанные нормальные значения ИММЛЖ. По данным литературы, чаще пользуются ЭхоКГ-критериями гипертрофии, предложенными R. Devereux (1984): ИММЛЖ у мужчин – более 134 г/м2, у женщин – более 110 г/м2. Однако в последние годы наметилась тенденция к использованию более низких значений ММЛЖ в качестве критерия его гипертрофии.
Концентрическая ГЛЖ, как правило, ассоциируется с высоким артериальным давлением, в то время как эксцентрическая ГЛЖ обычно связана с ожирением и увеличением объема циркулирующей крови.
При концентрической ГЛЖ повышение артериального давления обусловлено в основном ростом общего периферического сопротивления (ОПС) при незначительно увеличенном или нормальном сердечном выбросе. Концентрическая ГЛЖ развивается вначале как адаптивный процесс с целью уменьшения возросшего напряжения на стенки левого желудочка. Рост постнагрузки приводит к увеличению параллельных рядов саркомеров, происходит утолщение стенок и увеличение массы миокарда левого желудочка.
У больных АГ с эксцентрической ГЛЖ увеличен сердечный выброс с минимально повышенным или нормальным ОПС. Увеличение преднагрузки повышает диастолическое напряжение стенок левого желудочка, удлиняются саркомерные ряды кардиомиоцитов, расширяется полость и меняется форма (сферическая) левого желудочка.
Пациенты с концентрическим типом ремоделирования левого желудочка имеют относительно мягкую гипертензию с повышенным ОПС и сниженным сердечным выбросом. Для больных АГ с нормальным типом геометрии левого желудочка характерны невысокие значения показателей артериального давления; ОПС и/или сердечный выброс увеличены незначительно.
Помимо анатомических особенностей, функциональные изменения миокарда, в частности нарушение диастолической функции левого желудочка, также являются отражением процесса ремоделирования. ГЛЖ в настоящее время рассматривается как одна из важнейших причин нарушений расслабления левого желудочка. Признаки нарушения расслабления миокарда могут наблюдаться у больных с АГ и без ГЛЖ и зачастую обнаруживаются раньше, чем увеличение мышечной массы миокарда. Вероятно, это связано с опережающим развитием фиброза миокарда, являющегося важным фактором, ведущим к нарушению процесса расслабления миокарда. Исследования М. Lin и соавт. (1995) при сравнительной оценке структуры и функции левого желудочка у пациентов с АГ продемонстрировали значительное снижение диастолической функции левого желудочка, особенно в группе больных АГ с концентрической и эксцентрической ГЛЖ. Систолическая дисфункция отмечалась только при эксцентрической ГЛЖ.
=================
Вы читаете тему:
Типы ремоделирования миокарда левого желудочка при артериальной гипертензии и возможности медикаментозной коррекции
1. Типы ремоделирования миокарда левого желудочка при артериальной гипертензии.
2. Возможности медикаментозной коррекции на ремоделирование миокарда левого желудочка.
Павлова О. С., Нечесова Т. А. РНПЦ «Кардиология».
Опубликовано: “Медицинская панорама” № 6, сентябрь 2002.
Источник
Что такое концентрическое ремоделирование левого желудочка
Концентрическое ремоделирование миокарда левого желудочка считается наиболее распространенной формой данной болезни. Как правило, оно развивается в первую очередь у людей, имеющих артериальную гипертензию. Данный тип не имеет способности изменять внутреннее пространство левого желудочка, происходит лишь изменение стенок сердца и увеличение перегородки между сердечными отделами. Стоит сказать, что эта форма может начать свое развитие на фоне имеющейся гипертрофии левого желудочка. Кстати, гипертрофия, как правило, развивается при увеличенных физических нагрузках, либо же, как следствие гипертонии. Помимо стандартных причин возникновения, имеются и другие, которые не лучшим образом влияют на здоровье человека, а это могут быть пагубные привычки, такие как курение, злоупотребление алкоголем и др.
Начинается заболевание с гипертрофии левого желудочка и проявляется повышением толщины его стенки
Важно знать, что самостоятельная диагностика ремоделирования миокарда не приведет ни к чему хорошему, но, все-таки следует разбираться в первоначальных признаках, которые способствуют возникновению болезни, это такие, как:
- головная боль;
- сердечная боль;
- ухудшение общего состояния организма;
- скачки артериального давления;
- неравномерный сердечный ритм.
При первых же проявлениях подобных симптомов необходимо обратиться к специалисту, который должен назначить кардиограмму. Только этот метод исследования поможет определить наличие данной болезни. Следует сказать, что запущенная форма может привести к необратимым последствиям, например, к развитию хронической сердечной недостаточности.
Ремоделирование сердца
Нет ничего сложнее, нежели перенести тяжелую болезнь сердца, которая приводит также к определенным последствиям. Одной из таковых является ремоделирование сердца. Ремоделирование сердца — это структурные изменения органа, разрушающие его свойства в ответ на внешние воздействия и другие патологические процессы в организме человека.
Ремоделирование сердца проишодит под воздействием негативных факторов и заболеваний
Причины возникновения
Необходимо уточнить, что данный недуг может развиваться и на почве других сердечных заболеваний, это и приводит к особенным формам развития. Помимо таких негативных факторов, как болезни, ремоделирование миокарда может проявиться и как следствие некачественного лечения. Важно знать, что абсолютно разные причины влияют на развитие той или иной физиологической особенности сердца. О важности правильного диагностирования причин возникновения говорить не стоит, ведь это и так понятно, что следует в первую очередь обращать внимание на фактор, который способствовал возникновению данного анатомического изменения.
Вследствие повышенного артериального давления возникают некоторые болезни, которые приводят к данным изменениям. Помимо этих деформаций сердца, можно также наблюдать и другие нарушения:
- толщина кардиомиоцитов имеет ускоренный рост;
- растет количество саркомеров;
- сердечные стенки увеличиваются в размере.
Внимание! Кардиомиоцитами называют одноядерные клетки, из которых состоит миокард. Они в свою очередь имеют поперечное расположение, и вызывают повышенную прочность мышечной массы.
Большое значение имеет масштабность ремоделирования миокарда, которое имеет разные значения и объясняется двумя основными причинами возникновения:
| активация нейрогормонов | Подобный случай возникает в результате поражения организма инфарктом миокарда. Стоит сказать, что данная активация обусловлена значительным повреждением сердечной мышцы. Кстати, данная повышенная активация должна работать над регулированием общей работы сердечного органа и нормализацией артериального давления. Но, если не принять вовремя меры предосторожности, то такая патология перерастает в более тяжелую форму ремоделирования миокарда |
| симпатическая нервная система и ее активация | Данная причина возникновения основного недуга объясняется увеличенным напряжением левого желудочка. Это приводит к тому, что данному отделу необходимо большее количество кислорода |
Если говорить об эксцентрическом ремоделировании миокарда, то оно может быть вызвано значительной перегрузкой данной мышечной ткани. Кроме того, это сопровождается удлинением одноядерных клеток и уменьшением в размерах стенок сердца.
Патофизиология болезни
Сегодня инфаркт миокарда звучит не так страшно, как несколько лет назад. В большинстве случаев пациенты имеют возможность продолжать свою стандартную жизнедеятельность, несмотря на перенесенный стресс для сердца, да и всего организма. Стоит сказать, что качественное лечение и хорошая реабилитация, дают свои плоды, но, к сожалению, помимо этого, все же остаются последствия перенесенного инфаркта. Ремоделирование миокарда патофизиология которого только обостряется, имеет достаточно неприятные последствия. В данном случае, если своевременно не проводить квалифицированные осмотры, можно придать свой организм осложнениям, таким как плохое кровообращение и хроническая сердечная недостаточность.
Важно! Проведение качественной реабилитации и соблюдение рекомендаций специалиста является обязательными условиями при данном недуге. Если этого не придерживаться, можно получить тяжелые осложнения, которые приводят к плачевным результатам.
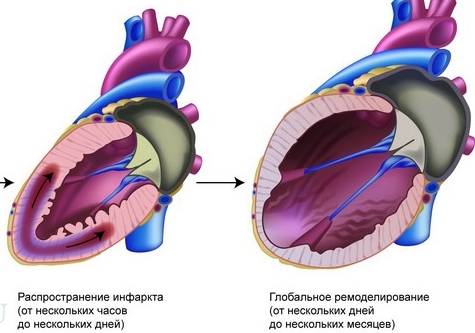
Инфаркт миокарда, как правило, приводит к серьезным физиологическим изменениям левого желудочка, что не очень хорошо сказывается на общем состоянии пациента. Такое изменение структуры сердечного отдела приводит также к следующим изменениям:
- стандартная форма левого желудочка представляет собой овальную форму, которая может меняться после перенесенного инфаркта, и приобретать сферические параметры;
- сама мышечная ткань ухудшается в своих качественных показателях, имеет свойство растягиваться и уменьшаться в размерах;
- появление частей, которые отмирают, к тому же их размерность имеет свойство увеличиваться и др.
Если проследить данную особенность, то можно заметить, что все процессы в организме взаимосвязаны, и ничего не возникает просто так. Из-за того что постоянно повышается артериальное давление, наша сердечная мышца пытается приспособиться к данному явлению. Как следствие, происходит изменение в размерах мышечной ткани. Именно так возникает данное заболевание, которое сопровождается рядом других недугов.
Источник
Добавочные почечные артерии не фигурируют в качестве признанного экспертами варианта реноваскулярной артериальной гипертензии (АГ), однако вполне очевидны теоретические предпосылки для ее развития и прогрессирования [1]. В почке, кровоснабжающейся добавочными почечными артериями, снижен кровоток за счет уменьшения площади поперечного сечения добавочных почечных артерий по сравнению с основной [2, 3]. Нарушение почечного кровотока оказывает неблагоприятное влияние не только на выделительную функцию почек, но и на гормональную систему, регулирующую артериальное давление [4].
Снижение скорости клубочковой фильтрации (СКФ), активация ренин-ангиотензин-альдостероновой системы (РААС) являются основными факторами развития гипертрофии левого желудочка, которая, как известно, увеличивает риск внезапной смерти, желудочковых аритмий и хронической сердечной недостаточности [5–7]. Однако структурно-функциональные изменения миокарда не всегда сопровождаются увеличением массы миокарда. В связи с этим в настоящее время принят термин «ремоделирование». Ремоделирование миокарда проявляется изменением размеров, формы и функции сердца в результате его повреждения и перегрузки. При этом варианты ремоделирования левого желудочка (нормальная геометрия, эксцентрическая гипертрофия, концентрическое ремоделирование, концентрическая гипертрофия) имеют различный прогноз [8].
Можно предположить, что степень активации РААС и снижения СКФ будут определять особенности ремоделирования миокарда у больных АГ с добавочными почечными артериями. Вместе с тем частота и характер ремоделирования миокарда у молодых больных АГ с добавочными почечными артериями остаются неизученными. Выявление взаимосвязи уровня ренина, СКФ с ремоделированием миокарда позволит не только конкретизировать патогенетические звенья формирования и прогрессирования АГ у больных с добавочными почечными артериями, но и улучшить процесс диагностики, а следовательно, правильный выбор антигипертензивной терапии, что замедлит прогрессирование заболевания, увеличит продолжительность и качество жизни данной категории пациентов.
Целью настоящего исследования было установить ассоциации патологического ремоделирования левого желудочка с уровнем ренина и СКФ у молодых больных АГ и добавочными почечными артериями.
Материалы и методы исследования
Обследовано 40 пациентов (33 мужчины и 7 женщин, средний возраст 27,05 ± 0,92 года) с АГ и добавочными почечными артериями. Критерии включения: подписание информированного согласия на участие в исследовании; мужчины и женщины с добавочными почечными артериями в возрастном диапазоне 18–35 лет. Критерии исключения: отказ пациента от участия на любом этапе исследования; вторичная АГ (стеноз магистральных ренальных сосудов, заболевания почек, надпочечников, опухоли, системные заболевания соединительной ткани и др.); сахарный диабет; хроническая сердечная недостаточность; беременность.
АГ устанавливали в соответствии с клиническими рекомендациями [9]. Добавочные почечные артерии верифицировали методом мультиспиральной компьютерной томографии, выполненной по сосудистой программе, и ретроградной (трансфеморальной) аортонефрографии.
АГ у обследуемых пациентов соответствовала 1–2 степени. Добавочные почечные артерии отходили от латеральной части аорты и чаще всего входили в верхний полюс (60% случаев), реже — в нижний (32,5%), в единичных случаях (5%) — одномоментно в оба полюса и в одном случае (2,5%) отмечена ранняя бифуркация. В случаях билатерального характера добавочных почечных артерий преобладала их верхнеполюсная локализация (78,57%), а при одностороннем отхождении — в равной степени верхне- и нижнеполюсная (соответственно 53,85% и 46,15%). В 60% случаев наблюдалось по 1 добавочной почечной артерии, в 32,5% — по 2 и в 7,5% — по 5.
Эходопплеркардиографию выполняли в одно- и двумерном режимах на аппарате Vivid-7 (Израиль) по общепринятой методике [10]. Тип ремоделирования левого желудочка устанавливали по индексу массы миокарда левого желудочка (ИММЛЖ) и относительной толщине стенок (ОТС). Массу миокарда левого желудочка рассчитывали по формуле: 0,8 × (1,04 × (конечный диастолический размер + толщина задней стенки левого желудочка + толщина межжелудочковой перегородки)3 — конечный диастолический размер3) + 0,6 (г). ИММЛЖ определяли как соотношение массы миокарда левого желудочка к площади поверхности тела, за норму у мужчин принимали значения 49–115 г/м2, у женщин — 43–95 г/м2. Относительную толщину стенки (ОТС) левого желудочка рассчитывали по формуле: (толщина задней стенки левого желудочка + толщина межжелудочковой перегородки) / конечный диастолический размер. При нормальном ИММЛЖ и ОТС < 0,43 определяли нормальную геометрию левого желудочка; при увеличенном ИММЛЖ и ОТС > 0,43 — концентрическую гипертрофию левого желудочка; при нормальном ИММЛЖ и ОТС ≥ 0,43 — концентрическое ремоделирование левого желудочка; при увеличенном ИММЛЖ и ОТС < 0,43 — эксцентрическую гипертрофию левого желудочка [9–11].
Расчет СКФ проводили по формуле СKD-EPI. Критерием снижения функции почек являлся уровень СКФ ниже 90 мл/мин/1,73 м2. СКФ в пределах 60–89 мл/мин/1,73 м2 расценивали как начальное или незначительное снижение, 45–59 мл/мин/1,73 м2 — умеренное снижение, 30–44 мл/мин/1,73 м2 — существенное снижение, 15–29 мл/мин/1,73 м2 — резкое снижение и < 15 мл/мин/1,73 м2 как терминальную почечную недостаточность [1].
Проводили иммуноферментный анализ плазменного уровня ренина (BCM Diagnostic). Диапазон нормы — 4,0–37,52 пг/мл.
Сформировывали группы сравнения из 15 пациентов с добавочными почечными артериями без АГ (12 мужчин и 3 женщины, средний возраст 26,27 ± 1,14 года) и 15 здоровых людей (12 мужчин и 3 женщины, средний возраст 26,0 ± 1,03 года).
Статистическая обработка осуществлялась с помощью программы IBM SPSS Statistics (версия 21 для Windows). Данные представлялись в виде среднего значения со стандартной ошибкой (M ± SЕ). Анализ проводили с помощью однофакторного дисперсионного анализа с поправкой Bonferroni. Различия считались статистически значимыми при величине р < 0,05. При 0,05 ≥ р < 0,1 рассматривали тенденцию к различию показателя.
Результаты и обсуждение
.gif) Патологическое ремоделирование левого желудочка, представленное эксцентрической гипертрофией и концентрическим ремоделированием, определено у 18 (45%) больных АГ с добавочными почечными артериями (рис. 1). Случаев концентрической гипертрофии левого желудочка верифицировано не было. У пациентов с добавочными почечными артериями без АГ и у здоровых людей во всех случаях определена нормальная геометрия левого желудочка.
Патологическое ремоделирование левого желудочка, представленное эксцентрической гипертрофией и концентрическим ремоделированием, определено у 18 (45%) больных АГ с добавочными почечными артериями (рис. 1). Случаев концентрической гипертрофии левого желудочка верифицировано не было. У пациентов с добавочными почечными артериями без АГ и у здоровых людей во всех случаях определена нормальная геометрия левого желудочка.
Патологическое ремоделирование миокарда левого желудочка у больных АГ 1–2 степени с добавочными почечными артериями свидетельствует об отсутствии достаточной компенсации повышенной нагрузки на сердце. Доказано, что риск сердечно-сосудистых осложнений нарастает в ряду: нормальная геометрия — эксцентрическая гипертрофия и концентрическое ремоделирование — концентрическая гипертрофия [8]. Примечательно, что характерной геометрической моделью левого желудочка у больных АГ 3-й степени с добавочными почечными артериями является концентрическая гипертрофия левого желудочка, характеризующаяся более высокими значениями ИММЛЖ [3]. Очевидно, у больных АГ 1–2 степени с добавочными почечными артериями имеется больше компенсаторных возможностей, чем у пациентов с добавочными почечными артериями и рефрактерной АГ 3-й степени.
Учитывая, что одним из основных факторов развития гипертрофии левого желудочка является активация РААС [5], у больных АГ с добавочными почечными артериями были исследованы уровни ренина с учетом наличия ремоделирования левого желудочка (табл.).
_575x.gif)
Оказалось, что у больных АГ с добавочными почечными артериями в случаях патологического ремоделирования левого желудочка плазменный уровень ренина характеризовался максимально высокими значениями, превышая соответствующие показатели как у здоровых, так и у больных с добавочными почечными артериями без АГ. Повышение ренина при АГ с нормальной геометрией левого желудочка не имело достоверной значимости.
Полученные результаты в определенной мере согласуются с данными о существенном влиянии уровня неактивного ренина на развитие гипертрофии и ремоделирование левого желудочка у больных гипертонической болезнью [5]. Ранее некоторые исследователи уже предлагали использовать высокую активность ренина плазмы в качестве предиктора гипертрофии левого желудочка у больных гипертонической болезнью [12]. В этой связи более высокий уровень ренина можно рассматривать как маркер патологического ремоделирования левого желудочка у молодых пациентов с АГ на фоне добавочных почечных артерий и, наоборот, патологическое ремоделирование левого желудочка — как отражение повышенного уровня ренина.
Известна взаимосвязь между функцией почек и состоянием сердечно-сосудистой системы, в том числе на ранних стадиях прогрессирования АГ [13]. У больных АГ с добавочными почечными артериями СКФ была ниже (94,62 ± 3,14 мл/мин/1,73 м2), чем у здоровых людей (110,29 ± 1,85 мл/мин/1,73 м2; р = 0,010), и характеризовалась тенденцией к снижению в сравнении с пациентами с добавочными почечными артериями без АГ (106,59 ± 2,96 мл/мин/1,73 м2; р = 0,069). Существенное снижение СКФ (36,42 мл/мин/1,73 м2) выявлено у 2,5% больных, а у 37,5% — незначительное (60–89 мл/мин/1,73 м2). Полученный результат свидетельствует о формировании сниженного функционального резерва почек у 40% молодых больных АГ 1–2 степени с добавочными почечными артериями. Нарушения, в том числе ранние субклинические, функции почек являются одним из важнейших факторов риска сердечно-сосудистых осложнений [4].
Мы сделали попытку уточнить взаимосвязь СКФ с развитием патологического ремоделирования левого желудочка у больных АГ и добавочными почечными артериями. Оказалось, что у больных АГ с добавочными артериями почек и патологическим ремоделированием левого желудочка СКФ была отчетливо ниже, чем в группах с добавочными артериями без АГ и здоровых людей (рис. 2).
.gif)
Таким образом, взаимообусловленность патологических процессов сердечно-сосудистой системы и почек позволяет рассматривать кардиоренальные взаимосвязи как непрерывную цепь событий, составляющих своеобразный порочный круг — кардиоренальный континуум [13]. Гормональный и гемодинамический факторы у молодых больных АГ 1–2 степени с добавочными почечными артериями создают нагрузку на левый желудочек, способствуя патологическому ремоделированию миокарда в виде эксцентрической гипертрофии и концентрического ремоделирования. Это позволяет выделить ведущий патофизиологический механизм повышения артериального давления, а также определить более успешную стратегию антигипертензивной терапии.
Выводы
- Для молодых пациентов с АГ 1–2 степени и добавочными почечными артериями характерно патологическое ремоделирование левого желудочка (45% случаев), преимущественно в виде эксцентрической гипертрофии и концентрического ремоделирования.
- Патологическое ремоделирование левого желудочка у больных АГ с добавочными почечными артериями было ассоциировано с более высокими показателями плазменного ренина и снижением СКФ (< 90 мл/мин/1,73 м2).
Литература
- Нефрология. Клинические рекомендации / Под ред. Е. М. Шилова, А. В. Смирнова, Н. Л. Козловской. М.: ГЭОТАР-Медиа, 2016. 816 с.
- Miclaus G. D. et al. Seve renal arteries: a case report using MDCT angiography// Rom. J. Morphol. Embryol. 2014. Vol. 55. P. 1181–1184.
- Гапон Л. И. и др. Рефрактерная артериальная гипертония в сочетании с аномалиями развития почечных артерий: штрихи к портрету // Сибирское медицинское обозрение. 2006. № 6. С. 38–41.
- Ахметова А. С. и др. Скорость клубочковой фильтрации при различных артериальных гипертониях / Медицинский журнал Западного Казахстана. 2015. № 1. С. 26–28.
- Гургенян С. В., Ватинян С. Х. Мультифакторный генез ремоделирования левого желудочка при эссенциальной артериальной гипертонии // Кардиология. 2013. № 5. С. 38–42.
- Зелвеян П. А., Дгерян Л. Г. Скорость клубочковой фильтрации как показатель поражения почек у больных с артериальной гипертензией // Евразийский кардиологический журнал. 2014. № 2. С. 44–48.
- Abramov D., Carson P. E. The role of angiotensin receptor blockers in reducing the risk of cardiovascular disease // J. Renin Angiotensin Aldosterone System. 2012. Vol. 13. P. 317–327.
- Полюхович Ю. И., Пырочкин В. М. Нарушение функции почек и кардиоваскулярная патология. Часть I. Факторы риска ремодулирования миокарда // Журнал Гродненского государственного медицинского университета. 2011. № 3. С. 17–20.
- 2018 ЕОК/ЕОАГ Рекомендации по лечению больных с артериальной гипертензией // Российский кардиологический журнал. 2018. № 12. С. 143–228.
- Lang R. M. et al. Recommenations for cardiac chamber quantification by echocardiography in adults: an update from the American society of echocardiography and the European association of cardiovascular imaging / // J. Am. Soc. Echocardiogr. 2015. Vol. 28. P. 1–39.
- Беленков Ю. Н. Ремоделирование левого желудочка: комплексный подход // Сердечная недостаточность. 2002. № 4. С. 161–163.
- Барсуков А. В., Корнейчук Н. Н., Шустов С. Б. Высокорениновые артериальные гипертензии: от симптома к диагнозу // Вестник Северо-Западного государственного медицинского университета им. И. И. Мечникова. 2017. № 2. С. 7–18.
- Ruilope L., Barkis G. Renal function and target organ damage in hypertension // Eur. Heart J. 2011. Vol. 32. P. 1599–1604.
Ю. П. Редько1
Н. Н. Гладких, доктор медицинских наук, профессор
А. В. Ягода, доктор медицинских наук, профессор
ФГБОУ ВО СтГМУ Минздрава России, Ставрополь
1 Контактная информация: jrsredko@gmail.com
DOI: 10.26295/OS.2019.35.37.004
Ремоделирование левого желудочка у больных артериальной гипертензией с добавочными почечными артериями: ассоциации с уровнем ренина и скоростью клубочковой фильтрации/ Ю. П. Редько, Н. Н. Гладких, А. В. Ягода
Для цитирования: Лечащий врач № 7/2019; Номера страниц в выпуске: 24-27
Теги: сердце, почки, артериальное давление, выделительная функция
Источник
