Церебральное перфузионное давление повышено
Внутричерепное давление (ВЧД)
Нормальное ВЧД колеблется от 5 до 12 мм рт. ст. Изменения ВЧД отражают изменения объема внутричерепного содержимого, заключенного в жесткой черепной коробке (вещество мозга 1200-1600 мл, кровь 100-150 мл, СМЖ 100-150 мл, ВКЖ (внеклеточная жидкость) <75 мл).
Изначально компенсаторные механизмы смягчают влияние внутричерепного объемного образования на ВЧД. К этим механизмам относятся перемещение СМЖ в спинальное субарахноидальное пространство, повышение абсорбции СМЖ и снижение внутричерепного объема крови. Тем не менее при исчерпании возможностей этих механизмов наступает критическая точка, после которой даже незначительное увеличение внутричерепного объема ведет к значительному увеличению ВЧД.
Если повреждение (отек) развивается медленно, то оно может достигнуть относительно большого объема до того, как начнется резкое повышение ВЧД. Напротив, повреждение, представляющееся, поданным КТ, небольшим, возможно, наросло быстро, не оставив времени на реализацию компенсаторных механизмов.
Причины повышения ВЧД
- Увеличение объема вещества головного мозга: опухоль, абсцесс, и гематома.
- Увеличение количества СМЖ: гидроцефалия, доброкачественная внутричерепная гипертензия.
- Увеличение объема крови: повышенный мозговой кровоток: гипоксия, гиперкапния, ингаляционные анестетики; увеличение мозгового венозного объема: повышенное внутригрудное давление, обструкция вен шеи, положение с опущенным головным концом, кашель.
- Увеличение внеклеточной жидкости: отек мозга.
Мозговое перфузионное давление (МПД)
МПД есть давление, действующее в результате тока крови к мозгу:
МПД = САД – (ВЧД + ВД).
Венозное давление (ВД) в бульбарной части яремной вены обычно равно нулю или ниже, и таким образом, МПД связано только с ВЧД и САД.
Мозговой кровоток (МК)
В норме мозговой кровоток обладает свойством ауторегуляции, которая поддерживает его при САД в пределах 50-140 мм рт. ст. За границами ауторегуляции, МК пассивно изменяется с перфузионным давлением.
У пациентов с хронической гипертензией верхняя и нижняя границы ауторегуляции выше нормальных, в результате чего АД, адекватная для нормальных пациентов, может вызвать ишемию мозга у пациентов с гипертензией. Ауторегуляция также остро нарушается или отключается при ацидозе мозговой ткани, что бывает при гипоксии, гиперкарбии, острых внутричерепных заболеваниях и после черепно-мозговой травмы.
Факторы, влияющие на изменение мозгового кровотока:
- Метаболизм. МК определяется в первую очередь метаболическими потребностями мозга. В связи с этим МК повышается при эпилептических судорогах и в связи с болью и тревогой. Напротив, МК снижается в коме при гипотермии или после введения анестетиков, таких как пропофол или барбитураты.
- Напряжение углекислоты. Гипокапния приводит к мозговой вазоконстрикции и снижению МК. Наиболее выраженным образом этот эффект проявляется при нормальном РаСО2, когда изменение на 1 кПа приводит к изменению МК на 30%. Артериальное давление модифицирует реакцию мозгового кровотока на гипервентиляцию. Высокое перфузионное давление ассоциируется с повышенной реакцией на гипервентиляцию, в то время как гипотензия 50 мм рт. ст. выключает влияние повышения или понижения РаСО2 на МК.
- Напряжение кислорода. РаО2 не является самой важной детерминантой МК, только после снижения ниже 7 кПа происходит церебральная вазоконстрикция.
- Температура. Гипотермия снижает метаболизм мозга, таким образом снижая и МК. С каждым градусом Цельсия температуры тела, метаболизм мозга снижается приблизительно на 5%.
- Вязкость. На МК не влияет, пока гематокрит остается в пределах 30-50%. При снижении за указанный предел МК усиливается.
- Анестетики.
Измерение внутричерепного давления
Желудочковое
Катетер, введенный в латеральный желудочек через фрезевое отверстие, — золотой стандарт измерения ВЧД. Катетер присоединяют либо к трансдусеру датчика давления, либо к устройству для оптоволоконного измерения давления. Этот метод позволяет дренировать СМЖ, как метод выбора для снижения ВЧД. К недостаткам методики относятся риск кровотечения при введении, а также риск развития вентрикулита, если катетер остается на длительный срок. Возможны трудности у пациентов с отеком мозга и маленьким желудочком.
Субдуральное
Полый болт устанавливают в кость черепа через фрезевое отверстие. Твердую мозговую оболочку надрезают и в субдуральное пространство проводят трансдуцер датчика давления или оптоволоконное устройство для измерения давления. Возможные осложнения — кровотечение и инфицирование. Субдурально измеренное ВЧД имеет тенденции к занижению истинного значения.
Интрапаренхимальное
Для мониторирования ВЧД в паренхиму мозга может быть введен микроминиатюрный силиконовый тензиметрический датчик. Популярность этой методики растет благодаря простоте выполнения и точности, в частности в ОРИТ, где она может быть осуществлена без участия нейрохирурга.
Экстрадуральное
Катетер в экстрадуральном пространстве не обеспечивает достаточно надежный уровень мониторинга ВЧД и в настоящее время вышеуказанный метод практически не применяется.
Общие принципы анестезии при повышенном ВЧД
Наличие у пациента повышенного ВЧД необходимо выявить до операции. Для него характерны следующие проявления и симптомы:
Ранние
- головная боль и рвота;
- судороги, локальные неврологические нарушения, отек соска зрительного нерва
Поздние
- повышенное АД и брадикардия;
- возбуждение, спутанность сознания, кома,
- дыхание Чейна-Стокса, апноэ;
- ипсилагеральное, а затем билатеральное расширение зрачка;
- декортикация, переходящая в децеребрацию.
Обследование: проанализировать данные КТ/ МРТ на наличие генерализованного отека мозга, смещения его структур, острой гидроцефалии, любых объемных образований, локального вокруг них отека, а также их размеры.
Цели ведения
Не допускать дальнейшего повышения ВЧД.
- Избегать повышения МК, не допуская гиперкапнии, гипоксии, гипертензии и гипертермии. Всегда использовать контролируемую ИВЛ для обеспечения управляемости РаСО2и хорошей оксигенации. При нарушенной ауторегуляции самые незначительные увеличения АД могут непредсказуемо влиять на МК. Анестезия должна быть адекватной и достаточно глубокой.
- Избегать повышения венозного давления. Избегать кашля, напряжения, положения с опущенной головой, обструкции шейных вен лентами, фиксирующими эндотрахеальную трубку.
- Избегать дальнейшего нарастания отека мозга. Несмотря на общее ограничение введения пациенту жидкостей, важно поддерживать внутрисосудистый объем и МПД. Не следует применять гипотоничные растворы, такие как раствор Гартмана или глюкозосодержащие. Переход жидкости через гематоэнцефалический барьер определяется осмоляльностью плазмы, но не онкотическим давлением. Жизненно важно поддержание высокой нормальной осмоляльности плазмы.
- Поддерживать МПД: гипотензия приведет к снижению мозговой перфузии в условиях повышенного ВЧД. Для сохранения МПД, до вскрытия твердой мозговой оболочки нормотензию следует поддерживать инфузией и, при необходимости, катехоламинами. Избегать анестетиков, повышающих ВЧД.
- Специфические меры снижения ВЧД: Уменьшение отека мозга осмо- или салуретиками или их комбинацией. Маннитол 0,25-1 г/кг инфузионно в течение 15 мин или фуросемид 0,25-1 мг/кг. Всем пациентам, получающим диуретики, устанавливают мочевой катетер.
- Осторожная гипервентиляция до РаСО2 4,0- 4,5 кРа оказывает преходящее влияние, снижающее ВЧД в течение 24 ч. Избыточная гипервентиляция приведет к мозговой ишемии и может стать причиной утраты ауторегуляции. Тем не менее следует помнить, что ЕТСО2 ниже, чем РаСО2.
- Кортикостероиды полезны для борьбы с отеком мозга, вызванным опухолью или абсцессом, но при черепно-мозговой травме их применение противоречиво. Для развития их действия необходимо несколько часов. Обычно назначают дексаметазон по 4 мг каждые 6 ч планово до операции.
- СМЖ может быть дренирована через наружный желудочковый дренаж или вентрикулоперитонеальный шунт.
- Положение пациента с приподнятым на 30 градусов головным концом кровати снижает центральное венозное давление. При этом нужно убедиться, что САД не слишком снизилось, так как конечным результатом может быть снижение МПД.
Анестетики и ВЧД
Ингаляционные анестетики
Ингаляционные анестетики снижают метаболизм мозга и его потребность в кислороде. В то же время в значительных дозах они повышают мозговой кровоток и ВЧД, нарушают ауторегуляцию. Галотан вызывает наибольшее повышение ВЧД, изофлюран — наименьшее. Концентрация изофлюрана менее 1 МАК на ВЧД не влияет.
Влияние на ЦНС и ССС севофлюрана и дезфлюрана представляются аналогичными изофлюрану. Энфлюран может вызывать судороги и в нейроанестезиологии ее применяется. Закись азота — слабый мозговой вазодилататор, вызывающий повышение МК и, таким образом, ВЧД. Кроме того, было показано, что она повышает метаболическую активность.
Внутривенные анестетики
Все внутривенные анестетики снижают мозговой метаболизм, МК и ВЧД, за исключением кетамина, который повышает ВЧД и в нейроанестезиологии не применяется. Реакция на углекислоту и ауторегуляция мозговой циркуляции хорошо сохраняются при анестезии пропофолом или тиопенталом. Оба обеспечивают определенную степень защиты мозга в результате снижения метаболизма мозга и, таким образом, потребность в кислороде.
Другие препараты
Суксаметоний вызывает фасцикуляцию мышц, повышающую венозное давление, а таким образом и ВЧД. Однако этот эффект не выражен, быстро проходит и не имеет существенного клинического значения. Суксаметоний таким образом все-таки следует применять в острых ситуациях (черепно-мозговая травма), когда потенциально «полный» желудок диктует необходимость быстрой последовательной индукции. При плановых операциях релаксация мыши и интубация могут быть обеспечены недеполяризующими релаксантами.
Наркотические анальгетики мало влияют на МК и ВЧД, если не становятся причиной респираторной депрессии, способной повысить РаСО2. Реакция на углекислоту сохраняется. Изначально были опасения, что альфентанил может повышать ВЧД, однако позднее было доказано, что это повышение вторично гипотензии, приводящей к мозговой вазодиляции и, как следствие, к повышению внутричерепного объема крови. Значимость эффекта не была доказана в случаях, когда препарат вводили медленно или в виде инфузии, что служит дополнительным свидетельством значения поддержания САД.
Источник
Интраабдоминальная гипертензия (ИАГ) (Intra-abdominal Hypertension (IAH)) и абдоминальный компартмент-синдром (АКС) (Abdominal Compartment Syndrome (ACS)) являются тяжелыми осложнениями заболеваний, как у хирургических, так и у нехирургических больных. Однако эти два сопутствующих явления, при своей высокой распространенности, часто остаются непризнанными или не диагностированными. ИАГ воздействует на региональную и общую перфузии, что может привести к полиорганной недостаточности и летальному исходу.
Наиболее ранним проявлением, даже при относительно низком уровне ИАГ, является олигурия и острое повреждение почек (ОПП). Профилактика ИАГ путем раннего выявления и мониторинга пациентов группы риска может полностью исключить развитие АКС. Понимание этиологии и патофизиологии ИАГ и AКС имеет важное значение для выявления патологии и может быть использовано в качестве руководства при его профилактике и осуществлении соответствующей терапии.
Определение и руководящие принципы ИАГ и АКС установлены Всемирным обществом абдоминального компартмент-синдрома (WSACS).
Интраабдоминальное давление (ИАД) — давление внутри брюшной полости.
В среднем у взрослого человека нормальный уровень ИАД находится в пределах 0–5 мм рт.ст., в то время как у тяжелобольных взрослых он обычно составляет 5–7 мм рт. ст.
Интраабдоминальная гипертензия (ИАГ) — постоянное или рецидивирующее патологическое повышение ИАД больше ≥ 12 мм рт.
Абдоминальный компартмент синдром (АКС) — устойчивая ИАГ (более 20 мм рт.ст.), при абдоминальном перфузионном давлении (АПД) < 60 мм рт. ст., связанная с новой дисфункцией/недостаточностью органов.
Абдоминальное перфузионное давление — это разница между средним артериальным давлением (САД) и ИАГ.
АПД является индикатором висцеральной перфузии, понятие которой уподобляется церебральному перфузионному давлению. WSACS определил нормальное АПД на уровне 60 мм рт.ст. или выше.
АПД менее 60 мм рт. ст. — надежный индикатор необходимости хирургической декомпрессии, что делает его полезным как в диагностике, так и в лечении.
Система классификации была разработана WSACS для ИАГ. Классификация ИАГ по степеням выглядит следующим образом:
- I степень: ИАД 12–15 мм рт. ст.;
- II степень: ИАД 16–20 мм рт. ст.;
- III степень: ИАД 21–25 мм рт. ст.;
- IV степень: ИАД > 25 мм рт.
С другой стороны, АКС дополнительно классифицируется в зависимости от причины и продолжительности ИАГ на первичную, вторичную и рецидивирующую.
- Первичный АКС — это состояние, ассоциированное с травмой или заболеванием в области брюшной полости, которое часто требует раннего хирургического или интервенционного рентгенологического вмешательства.
- Вторичный АКС относится к состояниям, которые не исходят из брюшной полости. Рецидивирующий АКС относится к состоянию, возникшему после предыдущего хирургического или медицинского лечения первичного или вторичного АКС.
Эти системы классификационных групп, разработанные WSACS, облегчают последующее управление ИАГ и АКС в рамках организации поэтапного подхода к ведению больных.
Наиболее распространенные факторы риска развития ИАГ и/или АКС в соответствии WSACS:
- снижение эластичности брюшной стенки;
- увеличение содержимого внутри просвета кишечника;
- увеличение внепросветного/внутрибрюшного содержимого;
- синдром капиллярной утечки и агрессивная инфузионная терапия.
Примечание. Некоторые из этих факторов риска далеки от патофизиологического обоснования и клинического суждения.
Развитие ИАГ у пациентов, которым проводится интенсивная терапия, связано с ухудшением клинического исхода, и это может наблюдаться у пациентов с тяжелым острым панкреатитом, распространенность интраабдоминальной гипертензии у этого типа пациентов составляет около 40–50 %, что обычно является осложнением ранней и агрессивной инфузионной терапии.
Помимо серьезных ожогов и сепсиса, которые являются одними из причин вторичного ИАГ/АКС, травмы и хирургические манипуляции в области живота являются предрасполагающими условиями, влияющими на развитие первичного ИАГ/АКС и, следовательно, послеоперационной почечной недостаточности. В проспективном наблюдательном исследовании, которое включало 263 пациента, ИАГ (определяемая как ИАП, превышающая или равная 18 мм рт.ст.) была независимой причиной нарушения функции почек после абдоминальной операции.
Чтобы понять основные принципы ИАГ и АКС, мы можем сравнить его в целом с компартмент-синдромом, когда повышение давления ухудшает капиллярный кровоток, в конечном итоге уменьшая приток в артериолы и уменьшая венозный отток. В дальнейшем это вызывает клеточную гипоксию, которая, в свою очередь, предшествует анаэробному дыханию и молочнокислому ацидозу.
Человеческое тело можно рассматривать как сочетания различных анатомических отделов, взаимодействующие друг с другом, по этой причине патофизиология внутриполостной гипертензии и компартмент-синдрома является многофакторной и может наблюдаться почти во всех системах органов.
ИАГ, очевидно, не только вызывает снижение перфузии во всех органах брюшной полости, но и оказывает влияние на внебрюшинные органы, а в некоторых случаях даже оказывает влияние на внутричерепное давление. Проще говоря, когда внутрибрюшное давление повышается, многие органы постепенно начинают отказывать. Было установлено, что ИАГ вызывает ряд патофизиологических изменений, начиная с региональных нарушений кровотока и заканчивая явной недостаточностью систем органов и развитием АКС.
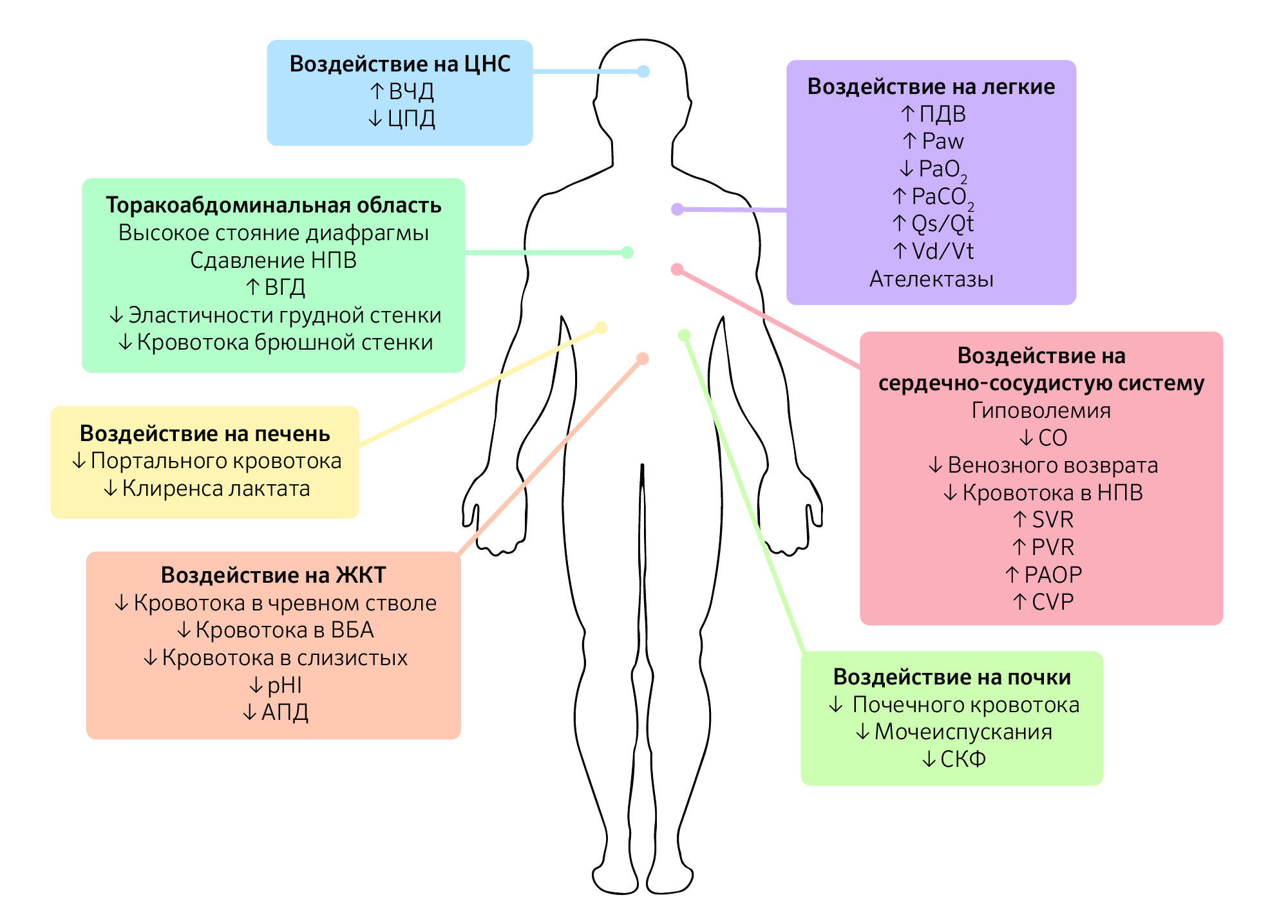
Помимо уровня ИАД и этиологии ИАГ у пациента, схожую по значимости роль играет коморбидность, которую следует принимать во внимание, поскольку это снижает порог ИАД, вызывающий клинические проявления (изображение 1).

Изображение 1 | Патофизиологические последствия интраабдоминальной гипертензии.
Последствия интраабдоминальной гипертензии не ограничиваются только органами брюшной полости, а, скорее, оказывают прямое или косвенное воздействие на каждую систему органов в организме. Схема влияния ИАГ на системы органов.
Сокращения: ВЧД — внутричерепное давление; ЦПД — церебральное перфузионное давление; ВГД — внутригрудное давление; НПВ — нижняя полая вена; ВБА — верхняя брыжеечная артерия; pHI — pH слизистой желудка ; АПД — абдоминальное перфузионное давление; ПДВ — пиковое давление вдоха; Paw, mean airway pressure —среднее давление в дыхательных путях; PaО2 — парциальное давление кислорода в артериальной крови; PaCO2 — парциальное давление углекислого газа в артериальной крови; Qs/Qt — внутрилегочный шунт; Vd/Vt — легочное мертвое пространство; CO, cardiac output — сердечный выброс; SVR — системное сосудистое сопротивление; PVR — легочное сосудистое сопротивление; PAOP — окклюзионное давление в легочной артерии; CVP — центральное венозное давление; СКФ — скорость клубочковой фильтрации.
Повышение ИАГ увеличивает внутригрудное давление путем брюшно-грудной передачи через краниальное смещение диафрагмы. Это явление создает прямое сжатие внутригрудных органов. Прямая компрессия сердца вызывает снижение сократительной способности, наполнения сердца и эластичности правого желудочка. ИАГ также приводит к нарушению венозного возврата, поскольку давление нижней полой вены увеличивается параллельно увеличению ИАГ, это отмечается даже при ИАД 10 мм рт. ст. Кроме того, отклонение диафрагмы вызывает анатомическое сужение полой вены, что приводит к дальнейшему снижению венозного возврата к сердцу и, в конечном счете, сердечного выброса. С другой стороны, сдавление легочной паренхимы приводит к сдавлению сосудистой сети, тем самым увеличивая легочное, аортальное и системное сосудистое сопротивление. Потому, несмотря на снижение венозного возврата и сердечного выброса, среднее артериальное давление остается стабильным, что делает его неточным гемодинамическим маркером.
Измерение давления на основе внутрисердечного или внутрисосудистого объема также имеет тенденцию быть недостоверным. Это объясняется тем, что, как окклюзионное давление легочной артерии (pulmonary artery occlusion pressure, PAOP), так и центральное венозное давление (central venous pressure, CVP) измеряются пропорционально барометрическому давлению, когда на самом деле эти показатели — сумма внутрисосудистого и внутригрудного давления.
Параметрами, которые более точно отражают состояние внутрисосудистого объема, являются следующие: конечный диастолический объем правого желудочка (right ventricular end-diastolic volume, RVEDV), общий конечный диастолический объем (global end-diastolic volume, GEDV) и ударный объем, поскольку они остаются незатронутыми изменениями внутригрудного давления.
Аналогичным образом повышенное ИАД передается в грудную клетку главным образом через отклонение диафрагмы, вызывающее сдавление легочной паренхимы. Паренхиматозное сжатие при ИАД 16 мм рт. ст. снижает эластичность легочной ткани на 50 %. Паренхиматозное давление также вызывает снижение емкости вдоха и функциональной остаточной емкости, в то время как пиковое инспираторное, экспираторное и среднее давление в дыхательных путях увеличиваются. В результате возникает альвеолярный ателектаз, увеличивается альвеолярное мертвое пространство, снижается легочный капиллярный кровоток, что приводит к снижению транспорта кислорода и снижению экскреции углекислого газа, а также увеличению фракции внутрилегочного шунта (Qsp/Qt) и рассогласованию вентиляции и перфузии (VQ) и, в конечном счете, к гипоксемии и гиперкапнии.
Несколько механизмов были предложены в качестве этиологии для ИАГ-индуцированной почечной дисфункции и недостаточности. Компрессия почечных артерий и вен в сочетании с компрессией почечных канальцев — вероятный механизм, лежащий в основе ИАГ/АКС-индуцированной почечной дисфункции и недостаточности, сопровождающейся снижением сердечного выброса. Различные авторы предположили, что прямое сдавление паренхимы провоцирует развитие «синдрома почечного компартмента», при котором почечный артериальный кровоток уменьшается, а почечное венозное давление и почечное сосудистое сопротивление повышается. Это приводит к тому, что кровь шунтируется от коры почек и клубочков, что приводит к нарушению функции клубочков и канальцев, вызывая ишемию почек и последующую почечную недостаточность.
При ИАД более 15 мм рт.ст. отмечается олигурия, в то время как анурия проявляется при ИАД более 30 мм рт. ст. Клинически наблюдаются изменения в функции почек, такие как снижение СКФ, повышение содержания азота мочевины в крови (BUN) и креатинина в сыворотке крови, увеличение фракционной экскреции натрия, снижение концентрации натрия и хлорида в моче и увеличение концентрации калия в моче. Однако все эти изменения, по-видимому, могут быть устранены, если ИАГ диагностируется и успешно управляется до того, как произойдет существенная дисфункция органа.
Высокое давление в брюшной полости вызывает мальперфузию кишечника из-за нарушения артериального и венозного кровотока. Было показано, что повышение ИАД на 10 мм рт. ст. снижает брыжеечный кровоток. Снижение перфузии кишечника вызывает ишемию кишечника и даже отек кишечника и кишечную непроходимость. Перфузия слизистой оболочки кишечника также нарушается, вызывая снижение рН и молочнокислый ацидоз, который в конечном итоге повреждает слизистый барьер кишечника. Потеря слизистого барьера приводит к внутрипросветной бактериальной транслокации, приводящей к сепсису или септическому шоку и последующему ухудшению исхода.
Повышенный ИАД существенно влияет на функцию печени. Прямое сжатие печени нарушает печеночный венозный и портальный кровоток. Кроме того, сужение печеночных вен на уровне диафрагмы ослабляет печеночный венозный кровоток, в то время как печеночный артериальный поток нарушается из-за снижения сердечного выброса.
На клеточном уровне микроциркуляторный кровоток также снижается, нарушая метаболизм глюкозы, вызывая увеличение производства лактата и одновременно нарушая механизм его утилизации.
Устойчивое и длительное повышение внутрибрюшного и внутригрудного давлений вызывает повышение внутричерепного давления (ВЧД) и снижение церебрального перфузионного давления (ЦПД). Bloomfield и соавторами в ходе двух различных исследований было установлено, что при повышении внутригрудного давления снижается мозговой венозный поток, что, в свою очередь, вызывает внутримозговой отек.
Раннее выявление пациентов группы риска является первым шагом в диагностике ИАГ и АКС. WSACS рекомендует проводить скрининг на ИАГ/АКС при наличии двух или более факторов риска. Рекомендация состоит в том, чтобы оценить ИАД на исходном уровне, и, если оно повышено, то ИАД необходимо продолжать контролировать каждые 4-6 часов.
Клиническое обследование, такое как пальпация и измерение окружности живота, оказалось крайне неточным и ненадежным в диагностике ИАГ и/или АКС. Радиографический ввод, такой как обычная рентгенография грудной клетки и/или живота, УЗИ брюшной полости, компьютерная томография и МРТ брюшной полости, также оказался ограниченным, поскольку результаты не являются ни чувствительными, ни специфичными для ИАГ и АКС. Тем не менее они могут продемонстрировать наличие возможной причины ИАГ, а также могут выявить воздействие ИАД (высокий уровень стояния диафрагмы, уплощение нижней полой вены, сжатие почечных вен и повышенное усиление стенки кишечника).
Когда комбинация рентгенологических данных сочетается с клинической картиной, тогда рентгенолог и врач-клиницист должны поднять вопрос о возможной ИАГ и/или АКС в качестве дифференциального диагноза.
Лучшим методом установления или исключения факта ИАГ является измерение внутрибрюшного давления. Существуют прямые и косвенные способы определения ИАД. Прямое измерение внутрибрюшного давления может быть выполнено с помощью внутрибрюшинного катетера с датчиком давления. Методы косвенного измерения включают определение любого из следующих давлений:
- давление в нижней полой вене;
- внутрижелудочное давление;
- внутрикишечное давление;
- внутриматочное давление;
- внутрипузырное давление.
В связи с положением мочевого пузыря в брюшной полости, внутрипузырный метод считается простым, точным и минимально инвазивным; следовательно, это надежный и воспроизводимый способ измерения ИАД.
При выполнении измерения, необходимо соблюдать несколько рекомендаций:
- Сообщать о ИАД в мм рт.ст. (1 мм рт. ст. = 1,36 см H2O),
- Пациент должен находиться в положении лежа на спине, чтобы избежать ложного повышения ИАД,
- Измерения должны проводиться в конце выдоха во время расслабления мышц живота,
- Датчик должен быть обнулен в середине подмышечной линии на уровне подвздошного гребня.
Необходимое оборудование
- Катетер Фолея с мочеприемником
- Система контроля давления
- Физиологический раствор изотонический с инфузионной системой.
- Кабель датчика/преобразователя
- Шприц 30 мл
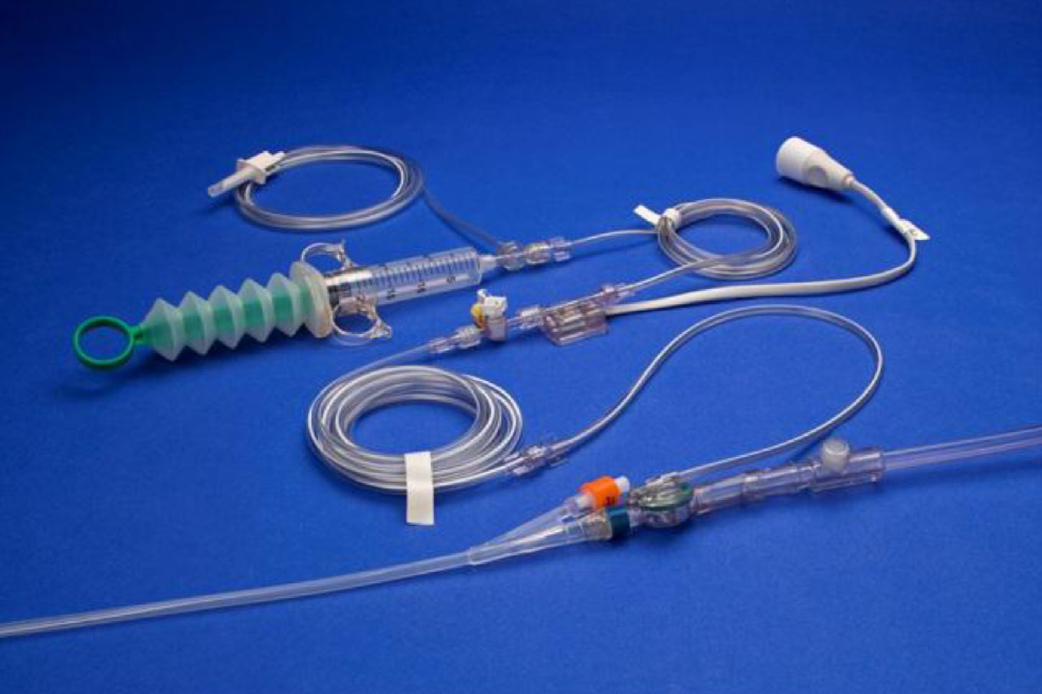
Изображение 2 | Система мониторинга ИАД ABVISER IPA
Шаги для измерения внутрипузырного давления:
- Подсоедините кабель датчика к монитору и настройте систему контроля давления.
- Расположите пациента в положении лежа на спине, чтобы избежать более высокого ИАД. Мочевой катетер устанавливается в полость мочевого пузыря.
- Отрегулируйте датчик и обнулите его так, чтобы атмосферный порт находился на уровне средней подмышечной линии, гребне подвздошной кости.
- Зафиксируйте катетер на расстоянии от порта, очистите порт спиртовым тампоном, затем подсоедините трубку датчика к порту отбора проб.
- Поверните кран на пациента и дайте шприцу заполнить максимум 25 мл по 0,9 % из пакета для внутривенного вливания.
- Поверните кран и введите 25 мл 0,9% физиологического раствора в мочевой пузырь.
- Освободите зажим на дренажной трубке для мочеиспускания, чтобы весь воздух удалялся из мочевого катетера.
- Подождите 30–60 с после установки для релаксации и стабилизации мышц детрузора мочевого пузыря.
- Измерьте ИАД в фазе выдоха, запишите показания давления на мониторе.
Установлено, что измерение ИАП имеет существенное прогностическое значение для тяжелобольных пациентов, так как ИАГ и АКС часто ассоциируются с неблагоприятными исходами. По этой причине ранняя и постоянная оценка, включая серийные измерения ИАД, должна контролироваться у любого пациента, у которого есть подозрение на ИАП/АКС.
Раннее распознавание имеет важное значение в управлении и благоприятном для пациента исходе. Необходимо понять патофизиологию ИАГ и АКС, исходить из более высокой настороженности и проверить наличие ИАГ у всех пациентов, имеющих факторы риска. В идеале хотелось бы иметь возможность диагностировать развивающийся ИАГ и АКС и вмешиваться до начала дисфункции и отказа органов и систем.
Предпочтительно, чтобы раннее терапевтическое вмешательство, будь то медицинские или хирургические попытки уменьшить ИАГ, рассматривалось как можно раньше. Руководящие принципы и рекомендации WSACS дают врачам полезное понимание ИАГ и АКС и их клинического управления для улучшения выживаемости пациентов.
Список литературы
- Meldrum D, Moore F, Franciose R, Sauaia A, Burch J. Prospective characterization and selective management of the abdominal compartment syndrome. Am J Surg . 1997;174(6):667–673. https://www.sciencedirect.com/… pii/S0 0 029610970 02018 . Accessed September 26, 2018.
- Eddy V, Nunn C, Morris J. Abdominal compartment syndrome: the Nashville experience. Surg Clin . 1997;77(4):801–812. https://www.surgical.theclinics.com/article/S0039- 6109(05)70585- 5/abstract . Accessed September 26, 2018.
- Tiwari A, Jenkins M, Amin A, Cheng K, Hamilton G. Regarding “Abdominal compartment syndrome after mesenteric revascularization. J Vasc Surg . 2002;35(4):831. https://www.jvascsurg.org/article/S0741- 5214(02)70067- 0/abstract . Ac- cessed September 26, 2018.
- Vidal, M., Weisser, J., Gonzalez, F., …MT-C care, 2008 undefined. Incidence and clinical effects of intra-abdominal hypertension in critically ill patients. https://journals.lww.com/ccmjo… 08/060 0 0/Incidence _ and _ clinical _ effects _ of _ intra _ abdominal.20.aspx . Accessed September 26, 2018.
- Holodinsky JK, Roberts DJ, Ball CG, et al. Risk factors for intra-abdominal hypertension and abdominal compartment syndrome among adult intensive care unit patients : a systematic review and meta-analysis. Crit Care . 2013;17(5):1. doi: 10.1186/cc13075.
- Hunt L, Frost SA, Hillman K, Newton PJ, Davidson PM. Management of intra-abdominal hypertension and abdominal compartment syndrome : a review. J Trauma Manag Outcomes . 2014;8(1):1–8. doi: 10.1186/1752- 2897- 8- 2 .
- Patel, A., Lall, C., …SJ-AJ of, 2007 undefined. Abdominal compartment syndrome. Am Roentgen Ray Soc . https://www. ajronline.org/doi/abs/10.2214/AJR.07.2092 . Accessed September 26, 2018.
Источник
