Горение при повышенном давлении
Адиабатическое горение — горение, происходящее при постоянном давлении или объёме, при котором отсутствуют потери энергии в окружающую среду. Адиабатическая температура горения — это температура продуктов, достигаемая при полном протекании химических реакций и установлении термодинамического равновесия. Адиабатическая температура горения при постоянном давлении ниже адиабатической температуры горения при постоянном объёме, так как в первом случае часть производимой при реакции энергии затрачивается на увеличение объёма системы.
Влияющие факторы[править | править код]
Так как при различных значениях окружающего давления химические свойства продуктов горения различаются, температура горения при постоянном низком давлении обычно ограничена уровнем ионизации получаемого газа. Различные виды топлив с разными теплотами сгорания и с разным молекулярным составом будут иметь различные температуры горения. Полное сгорание в реальных системах не происходит, так как химические реакции приводят к диссоциации компонентов и происходят с конечной скоростью, что изменяет соотношение компонентов и не позволяет достичь полного термодинамического равновесия.
Существует большое количество программ для расчёта температуры горения с учётом диссоциации. Эти программы используют константы равновесия (Stanjan, NASA CEA, AFTP) или минимизируют термодинамические потенциалы.
Распространенные виды топлив[править | править код]
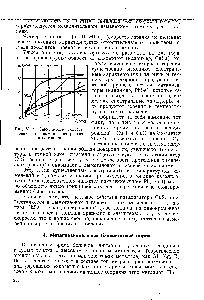
Наиболее распространенными, повседневно используемыми видами топлива являются такие органические соединения и их смеси, как древесина, воск, жиры, различные пластмассы, природный и нефтяной газы, бензин. В таблице приводится адиабатическая температура горения этих и других веществ в воздухе и кислороде при нормальных условиях (750,06 мм рт.ст. и 25 °С), при близком к единице соотношении («») (англ.)русск. топливо/окислитель и при том условии, что в результате реакции давление системы остается неизменным.
- ↑ Температура, равная ≈3200 K, соответствует 50 % химической диссоциации CO2 при давлении 1 атм. Последнее значение остается постоянным при адиабатическом горении, а CO2 составляет 97 % выхода реакции горения антрацита в кислороде. Более высокие температуры этой реакции должны наблюдаться при более высоком давлении (до 3800 K и выше, см. Jongsup Hong et al, стр.8).
Термодинамика[править | править код]
Первый закон термодинамики для изолированной системы можно записать в виде:
где, and тепло и работа, соответственно, которые были произведены в ходе процесса, а и — внутренняя энергия реагентов и результатов реакции. Если предположить, что при адиабатическом горении сохраняется неизменность объема, то процесс не производит работы,
и не происходит потери тепла, так как процесс предполагается адиабатическим: . В результате внутренняя энергия продуктов реакции совпадает с внутренней энергией реагентов: . Так как это изолированная система, масса продуктов и реагентов постоянна и первый закон может быть записан в следующем виде:
.
Если предположить, что при адиабатическом горении сохраняется неизменность давления, то для произведенной работы выражение может быть записано как,
Так как в адиабатическом процессе не происходит потери тепла , из первого закона мы получаем, что
Так как из определения энтальпии , а в изолированной системе масса продуктов и реагентов постоянна, первый закон принимает следующий вид:
.
Таким образом, адиабатическая температура горения при постоянном давлении меньше, чем при постоянном объёме, что связано с необходимостью произвести работу для увеличения объема в первом случае.
Если предположить, что имеет место полное сгорание и выполнены условия стехиометрии компонентов, или имеет место избыток окислителя, для вычисления температуры горения может быть использована следующая формула:
Точное соотношение компонентов не даёт достаточного количества переменных для вычислений, так как для достижения молярного баланса требуются и — последние соединения являются наиболее распространёнными продуктами неполного сгорания богатой смеси.
Однако, если учесть реакцию обмена между углекислым газом и водой
и использовать константу равновесия для этой реакции, то в результате количество переменных будет достаточным для определения температуры.
Современные пакеты программ для термодинамических расчетов позволяют находить адиабатическую температуру в результате численного решения задачи максимизации энтропии при заданных давлении и энтальпии системы (заданных объеме и внутренней энергии). При этом естественным образом учитывается диссоциация продуктов сгорания (при соответствующем выборе компонентов, составляющих систему). Численное решение значительно упрощается при выпуклой зависимости энтропии системы от температуры. Для этого необходима неотрицательность производной удельной теплоемкости при постоянном давлении по температуре (выполняется практически всегда, поэтому для программной реализации расчета адиабатической температуры могут быть использованы стандартные алгоритмы из теории выпуклого программирования).
См. также[править | править код]
- Адиабатический процесс
- Цикл Дизеля (цикл постоянного давления)
- Цикл Отто (цикл постоянного объема)
Примечания[править | править код]
Ссылки[править | править код]
- (англ.) Babrauskas, Vytenis Temperatures in flames and fires. Fire Science and Technology Inc. (25 февраля 2006). Дата обращения: 27 января 2008. Архивировано 17 мая 2012 года.
- (англ.) Computation of adiabatic flame temperature
- (англ.) Adiabatic flame temperature
- (англ.) Adiabatic Flame Temperature. The Engineering Toolbox. Дата обращения: 27 января 2008. Архивировано 17 мая 2012 года. adiabatic flame temperature of hydrogen, methane, propane and octane with oxygen or air as oxidizers
- (англ.) Flame Temperatures for some Common Gases. The Engineering Toolbox. Дата обращения: 27 января 2008. Архивировано 17 мая 2012 года.
- (англ.) Temperature of a blue flame and common materials
- (англ.) Online adiabatic flame temperature calculator using Cantera
- (англ.) Adiabatic flame temperature program
- (англ.) Gaseq, program for performing chemical equilibrium calculations.
- (англ.) Flame Temperature Calculator – Constant pressure bipropellant adiabatic combustion
- (англ.) Adiabatic Flame Temperature calculator
Источник
| Рис. 119. Зависимость скорости горения от давления стехиометрической смеси ТНМ — бензол | 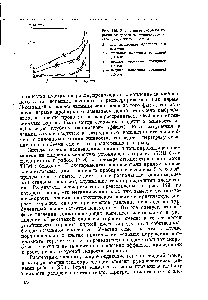 |
В. Зависимость скорости горения от давления [c.16]
| Рис. v.u. Зависимость скорости горения от давления для различных топлив. |  |
ЗАВИСИМОСТЬ СКОРОСТИ ГОРЕНИЯ ОТ ДАВЛЕНИЯ [c.152]
Таким образом, можно сделать вывод о возможности создания порохов с пониженной зависимостью скорости горения от давления и начальной температуры в области высокого давления. [c.129]
Если интересоваться только зависимостью скорости горения от давления и размера частиц, можно переписать (80) в виде [c.99]
Аналитическая зависимость скорости горения от давления и=0,4-Р [c.194]
V в формуле тп = Ър и порядок ведущей реакции п = 2у, то для конденсированных смесей величина V в значительно меньшей степени определяется порядком реакции и зависит от многих других параметров (от дисперсности компонентов, от их летучести, от теплоты их газификации и т. д.). Отсутствие зависимости скорости горения от давления для нелетучих В В принято объяснять тем, что в данном случае ведущей является реакция в конденсированной фазе. [c.155]
Нужно иметь в виду, что в связи с нелинейным характером зависимости скорости горения от давления для некоторых взрывчатых веществ ряд по степени устойчивости горения, полученный при одном давлении, может не совпадать с рядом при другом давлении, что видно из приведенных в табл. 6 данных. [c.93]
Сложность проблемы видна из работы Адамса и Кука [ ], которые нашли, что в некотором интервале давлений зависимость скорости горения от давления соответствует эффективному порядку реакции, меньшему единицы [это было установлено при помощи уравнения (3)], даже в том случае, когда рассмотренный ими цепной механизм включает элементарные реакции только первого, второго и третьего порядка. [c.182]
В свою очередь модели твердофазного горения позволяют предсказать тепловыделение в твердой фазе, температурную чувствительность скорости горения и действие катализаторов, но не дают указаний о зависимости скорости горения от давления. [c.69]
Свое дальнейшее развитие теория устойчивости получила в работе Андреева [8]. Рассмотрение проводили для случая торцевого горения цилиндрического заряда с учетом зависимости скорости горения от давления в виде Мм = -4 + Вр ( ) Использовали выражение для газоотвода, справедливое для критическое [c.58]
А м по сравнению с экспериментом. Это указывает на необходимость проведения расчета, который учитывал бы зависимость скорости горения от давления и скорости газового потока а также характер распространения горения по трещине. [c.126]
ВЛИЯНИЕ КОНДЕНСИРОВАННОГО ОСТАТКА НА ЗАВИСИМОСТЬ СКОРОСТИ ГОРЕНИЯ ОТ ДАВЛЕНИЯ [c.119]
Горение ЖВВ за пределом устойчивости характеризуется прежде всего высокими скоростями распространения процесса, сильной зависимостью скорости горения от давления как правило, существенно влияет на скорость горения диаметр сосуда, в котором проводится сжигание. [c.242]
Зависимость скорости горения от давления р и от скорости газа и вблизи поверхности заряда представляют в виде [c.118]
Зависимость скорости горения от давления среды, т. е. давления в камере сгорания, многократно определялась экспериментально и подчиняется простым математическим зависимостям. В общем виде зависимость скорости горения от давления показана на рис. 4.2. График представленной зависимости принято условно делить на три части по пределам давления в камере сгорания. [c.169]
На основе предложенного в работе [114] подхода нами был проведен расчет Д м в деформируемой поре [110], отличающийся от изложенного выше тем, что вместо выражения А м ( / ) вида (54), справедливого для малых А /) , в расчет закладывалась экспериментальная зависимость (50). Это позволило определить избыточное давление Д /) м в широком диапазоне его изменения 0,1 возникновения звукового истечения. Кроме того, выражение (50) учитывает процесс поджигания, зависимость скорости горения от давления и скорости газа в трещине, а также нестационарные эффекты, поэтому не требуется введения специальных предположений, касающихся условий поджигания и характера горения пороха в трещине. Наконец, про- [c.131]
Область нормального горения. Характеризуется ровным фронтом пламени, стационарным распространением горения. Зависимость скорости горения от давления здесь обычно весьма близка к линейной. [c.227]
В согласии с теорией, критической точкой будет такая скорость горения, выше которой колебания отсутствуют, а происходит только рост возмущений по амплитуде. Экспериментально эта точка должна определяться в условиях, исключающих влияние искусственных возмущений. Режим, отвечающий горению в закритической области, характеризуется сильной и монотонной -Зависимостью скорости горения от давления (по крайней мере вблизи от предела), а предкритическая область сопрягает ее с областью зависимости медленного горения от давления. Это обстоятельство в сочетании с фоторегистрациями горения позволяет находить критическую точку с достаточной определенностью. [c.237]
В данной книге иет возможности глубоко вникнуть в теорию скорости горения. Поэтому ограничимся лишь видом зависимостей скорости горения от давления, которые могут быть выведены на основании теории горения. Результаты приведены в табл. 7.2 [14]. [c.142]
Попытки экспериментально определить зависимость скорости горения от давления предпринимались для кислородных и воздушных смесей различных горючих с использованием разных методов измерения скорости горения [15]. Некоторые из этих методов дают сомнительные результаты, особенно для низких скоростей горения из-за теплопотерь, вызванных электризацией и охлаждением на срезе горелки, проявляющихся тем сильнее, чем ниже давление. Тем не менее были получены следующие общие закономерности. [c.142]
Э.- мощное бризантное ВВ, но менее чувствительное к удару и трению, чем нитроглицерин. Скорость детонации 7200 м/с, может детонировать с малой скоростью 1000-3000 м/с критич. диаметр детонации 1,9 мм. Объем газообразных продуктов взрыва 0,737 м /кг АЯмрыва -6600 кДж/кг. Жвдкий Э. при давлениях ниже 1 МПа горит стационарно (при 0,1 МПа скорость горения 0,3 ммУс критич. диаметр 10 мм). При давлении выше 1,5 МПа Э. горит в турбулентном режиме зависимость скорости горения от давления становится в десятки раз более сильной, хотя и сохраняет линейный характер. [c.497]
Методики испытаний образцов отвечали общепризнанным государственным и отраслевым стандартам, а именно предел прочности и относительное удлинение определяли в соответствии с требованиями ГОСТ 269-66, плотность – по ГОСТ 18995.1-73, температуру стеклования -по ГОСТ 12254-66, чувствительность к удару – по ОСТ В-84-892-74, чувствительность к трению – по ОСТ В-84-895-74. Зависимость скорости горения от давления определяли на установке постоянного давления, вязкость топливной массы – на реотесте, химическую стойкость – с использованием манометров Бурдона. Энтальпию образования рассчитыватш исходя из структурной формулы каждого из соединений с учетом термодинамических поправок для входящих в него группировок [5], энергетические характеристики – по программам МГТУ им. Н. Э. Баумана. [c.190]
Зависимость скоростп горения от дисперсности комионентов для первой группы смесей является более слабой, чем для второй. Напротив, слабая зависимость скорости горения от давления гораздо чаще наблюдается для смесей, относящихся ко второй группе. [c.123]
ОТ скоростей диффузии газообразного горючего п окислителя к конусообразной поверхности пламени над газовыми гранулами горючего (см. также работу [ ]). Детально разработанная, поддающаяся строгому анализу модель с диффузионным пламенем, в которой пламя располагалось над чередующимися слоями горючего и окислителя, была предложена и проанализирована Нахбаром [ ]. В этой модели приняты во внимание процессы на поверхностях горючего и окислителя, учтено различие средних высот и средних температур пламени над горючим и окислителем, различие в толщине слоев окислителя и горючего, а также отличие состава твердого топлива от стехиометри-ческого. Хотя выводы этой теории находятся в приблизительном соответствии с экстраполированной экспериментальной зависимостью скорости горения от размера частиц окислителя, наиболее существенным возражением против диффузионного механизма горения в данном случае является то, что он всегда предсказывает независимость скорости горения от давления (см. главу 3). Чтобы в этой модели получить наблюдаемую зависимость скорости горения от давления, необходимо ввести в рассмотрение либо экзотермическое гомогенное газовое пламя либо пламя разложения, примыкающее к поверхности одного из конденсированных реагентов, либо учесть процесс горения смеси горючего и окислителя в потоке после смешения. [c.288]
В работе [11] дан исчерпывающий обзор термических характеристик ЦТЭТН и ЦТМТН, включающий физические сворютва, особенности разложения, воспламенения и самовозгорания этих соединений. Обсуждаются возможные механизмы реакций на основе результатов испытаний в ударных трубах, экспериментальных исследований воспламенения зарядов ТРТ и зависимости скоростей горения от давления и начальной температуры в широком диапазоне значений этих параметров. [c.35]
Одной из первых моделей горения СТТ была модель Нахбара и Паркса [125], называемая моделью послойного диффузионного пламени, сущность которой иллюстрирует рис. 33, а. В модели предполагается, что топливо имеет вид чередующихся слоев горючего и окислителя конечной толщины. Поверхность раздела между конденсированной и газовой фазами предполагается сухой (без расплавленного слоя). Такая теория не преуспела в предсказании зависимости скорости горения от давления. [c.69]
Эксперименты [156, 170] выявили важную роль реакций в коденсированной фазе. Германе [72] предложил и детально разработал статистическую модель, позволяюш ую определить зависимость скорости горения от давления. В модели учитываются гетерогенность структуры поверхности СТТ и тепловыделение на поверхности или под ней. Основными допущениями, которые легли в основу теории, являются определяющая реакция на поверхности раздела ПХА — связующее и плоское одиночное пламя в подготовленной газовой смеси. Модель позволяет прогнозировать 1) связь между скоростью горения и давлением, согласующуюся с экспериментальными данными, [c.70]
Рассчитанное значение расхода твоспл, как правило, проверяется опытными сжиганиями воспламенителей. Величину / рИгор(0 определяют из анализа методом конечных элементов. На величину Л гор (О оказывают влияние следующие факторы зависимость скорости горения от давления в камере РДТТ, массовый расход, температура заряда, ускорение ракеты, а также скорость распространения фронта пламени вдоль канала заряда после воспламенения. На стадии догорания заряда величина Лгор значительно уменьшается, и соотношение (5.7а) можно использовать для оценки влияния изменения давления на скорость горения. После выгорания топлива первый член в уравнении (5.7а) исчезает, и [c.105]
Зависимость скорости горения от давления для образцов тэна с различной дисперсностью и плотностью представлена на рис. 60. Б области малых давлений наблюдается устойчивое послойное горение, скорость которого почти не зависит от плотности и линейно растет с давлением. При достижении критического давления происходит резкое увеличение скорости и возникает конвективный режим, характерной особенностью которого является сильная зависимость скорости горения от давления Ыв = Ьр , где V > 1. Некоторое ослабление зависимости (р) при больших давлениях связывается с влиянием разбавления порошка ВВ газом (азотом), который выполняет роль инертной добавки, понижаюш,ей телше-ратуру проникающих в поры продуктов горения. Масса азота возрастает с уменьшением плотности ВВ и с увеличением давления. [c.138]
В качестве катализаторов были использованы 1) кристаллйче ское субдисперсное а-Ре ( о= 50 нм) 2) окись железа РегОа, со державшая а-РезОз (й оДобавки катализатора вводились сверх 100% в количестве 1% (масс). Исходная смесь ПХА + ПММА обозначалась как смесь А, та же смесь с добавкой Ре, РезОз и ферроцена обозначалась соответственно как А+Ре, А+РегОз и А + Ф. Были исследованы следующие параметры горения скорость горения, структура и температура поверхиости, максимальная температура пламени, спектральный состав продуктов горения по высоте пламени. Результаты определения скорости горения. смесей в зависимости от давления показывают, что в данных условиях в исследуемом интервале давлений все добавки увеличивают скорость горения а 20—40%. Введение катализаторов привело также к изменению закона зависимости скорости горения от давления. [c.309]
Необходимо подчеркнуть, что каяедый из перечисленных параметров влияет на скорость горения топлив не изолированно, а в тесной связи друг с другом. Так, например, зависимость скорости горения от давления тесно связана с соотношением ко шонентов в топливе, а в ряде случаев — также и с дисперсностью и начальной температурой. Е> свою очередь давление может влиять на зависимость скорости горения от соотношения компонентов и т. д. [c.77]
Значения коэффициента р зависят от природы комнонентов топлива, размера частиц окислителя, соотношения компонентов, технологии приготовления топлив. Смесевые твердые ракетные топлива имеют меньшую температурную чувствительность скорости горения, чем гомогенные топлива. Р1ужно отметить, что определение указанных зависимостей скорости горения от давления и начальной температуры производится, как правило, экспериментальным путем. [c.78]
Источник
