М а гуревич артериальная гипертония у

Артериальная гипертензия (АГ) в женской популяции характеризуется рядом гендерных особенностей, что играет немаловажную роль в развитии ишемической болезни сердца (ИБС).
По данным исследований NHANES II, ГНИЦПМ, частота АГ у женщин с возрастом стремительно растет: в 55–64 лет она составляет 46,5–53%, а в группе старше 65 лет — 68% [1].
Nanchanal et al. в исследовании, включавшем 14 тыс. здоровых женщин, показали, что риск развития ИБС в течение последующих 10 лет их жизни тесно связан с уровнем АД. Риск для женщин с высоким нормальным АД был в 4 раза больше, чем для женщин с нормальным АД. У женщин с АГ, даже получавших удовлетворительную гипотензивную терапию, риск ИБС был в 8 раз выше. Для женщин с неадекватной терапией риск был выше почти в 19 раз [2].
Помимо показателей АД (по данным исследования NHANES III, после 59 лет у женщин отмечается максимальная частота АГ) у женщин, по сравнению с мужчинами, выше частота сердечных сокращений (ЧСС) в покое, сердечный индекс, ниже общее периферическое сопротивление сосудов, наблюдается высокая вариабельность АД, чаще выявляется «гипертония белого халата».
Важная особенность АГ у женщин — тенденция к нарастанию пульсового давления как суррогатного маркера жесткости артериальной стенки, в связи с тем что после 50 лет уровень систолического АД (САД) у них продолжается увеличиваться, в то время как уровень диастолического АД (ДАД) удерживается на прежних значениях или даже снижается [3].
Считается, что причинами, приводящими к этим изменениям у женщин, являются меньшая протяженность артериального русла, большая ЧСС, более короткая диастола и низкий ударный объем [4]. Повышение уровня пульсового давления считается мощным независимым предвестником последующих коронарных событий [5].
Гипертрофия левого желудочка (ГЛЖ) у женщин встречается чаще, чем у мужчин, причем преобладает концентрическая ГЛЖ (утолщение стенок левого желудочка (ЛЖ) без изменения размеров полости). У мужчин же чаще встречается эксцентрическая ГЛЖ [6].
Исследование WHJ, в котором принимали участие 98 705 женщин в возрасте 50–79 лет, выявило АГ у 38% пациенток. Доказана достоверная прямая зависимость между частотой встречаемости АГ и возрастом — у женщин 70–80 лет АГ встречалась в 2 раза чаще, чем в возрасте 50–60 лет [7].
Основными факторами риска (ФР) развития АГ являлись вес тела (частота встречаемости АГ составила 48% против 29% соответственно с ИМТ>27,3% и ИМТ<27,3%); наличие/отсутствие физической активности (соответственно 45% против 31%); потребление алкоголя (соответственно 46% и 36% у злоупотребляющих алкоголем). Часто формирующееся абдоминальное ожирение, зачастую сочетающееся с нарушениями углеводного и липидного обмена, влечет за собой развитие инсулинорезистентности, которая приводит к снижению синтеза оксида азота (NO), повышению содержания свободных жирных кислот, угнетению активности NO-синтетазы. Все это способствует повышению чувствительности эндотелиальной стенки к констрикторным действиям различных веществ, в свою очередь повышая частоту развития АГ [8, 9].
Период постменопаузы характеризуется перестройкой эндокринной системы и дефицитом синтеза эстрогенов, оказывающих влияние на резистентность периферических сосудов, синтез нейромедиаторов, вазоактивных пептидов, простациклина и тромбоксана.
Важную роль в патогенезе АГ у женщин в постменопаузе играет как снижение уровня женских половых гормонов, так и увеличение уровня андрогенов в крови. Повышение уровня тестостерона вызывает увеличение активности симпатоадреналовой (САС) и ренин-ангиотензин-альдостероновой систем (РААС). Тестостерон оказывает прямое действие на канальцы почек, способствуя задержке натрия в организме. Кроме того, тестостерон увеличивает уровень эндотелина в крови и усиливает оксидативный стресс.
Ожирение является независимым ФР коронарных заболеваний, застойной сердечной недостаточности (ЗСН), инсультов; большинство из них является исходами плохо контролируемой АГ. У женщин с ожирением сердечно-сосудистый риск увеличивается в 4 раза.
По данным исследования АРГУС, в России среди женщин старше 55 лет нормальную массу тела (ИМТ<25 кг/м2) имели 24% пациенток с впервые выявленной изолированной систолической АГ (ИСАГ) и 40% — с систолодиастолической АГ. Кроме того, в развитии АГ у женщин (кроме менопаузы!) имеют значение гиперхолестеринемия, отсутствие физической активности и психологические факторы.
У большинства женщин, принимающих пероральные контрацептивы, наблюдается небольшое, но достоверное повышение АД. Следует отметить, что в настоящее время пероральные контрацептивы содержат более низкие дозы эстрадиола (20–35 мг), но все равно необходимо проводить регулярное измерение АД каждые 6 мес.
По данным исследования TOMHS [10], у женщин зарегистрировано в 2 раза больше нежелательных явлений, чем у мужчин.
Следует сделать ряд заключений по АГ у женщин:
- у мужчин наблюдается тенденция к более высоким цифрам АД по сравнению с женщинами репродуктивного возраста, после наступления менопаузы или проведения овариоэктомии различия между мужчинами и женщинами исчезают;
- у женщин до 60 лет распространенность АГ ниже, после 60 лет — выше, чем у мужчин;
- ИСАГ чаще встречается в возрасте старше 60 лет, преимущественно у женщин с избыточной массой тела;
- в репродуктивном периоде риск сердечно-сосудистых осложнений у женщин в 3 раза ниже, чем у мужчин;
- АГ не является абсолютным противопоказанием к назначению заместительной гормональной терапии (ЗГТ);
- современные препараты для ЗГТ не оказывают существенного влияния на уровень АД у женщин с/без АГ в менопаузе;
- наличие отягощенной наследственности и заболеваний почек в анамнезе является относительным противопоказанием для назначения пероральных противозачаточных средств;
- у женщин чаще наблюдается ГЛЖ при ИСАГ, а также инсульт и ЗСН на фоне АГ;
- женщины более осведомлены о наличии у них АГ, чаще получают антигипертензивные препараты, у них в отличие от мужчин выше вероятность достижения целевого АД;
- антигипертензивная терапия оказывает одинаковое влияние на уровень АД у мужчин и женщин. Однако у женщин наблюдается менее выраженное снижение общего сердечно-сосудистого риска на фоне адекватного контроля АД.
Ретроспективный анализ 5 рандомизированных клинических исследований, включавших 12 тыс. пожилых больных, преимущественно женщин (возраст старше 60 лет), показал, что активное снижение АД сопровождалось снижением сердечно-сосудистой смертности на 23%, количества случаев ИБС — на 19%, случаев сердечной недостаточности (СН) — на 48%, частоты инсультов — на 34%.
Целесообразны снижение и поддержание АД на уровне ≤140/90 мм рт. ст., а при сопутствующих сахарном диабете (СД) и почечной недостаточности АД следует снижать до <135/85 мм рт. ст.
Начинать терапию нужно с устранения модифицируемых ФР, таких как избыточный вес, курение, чрезмерное употребление соли.
Различия в фармакокинетике лекарств у мужчин и женщин могут быть обусловлены более низкой массой тела у женщин, меньшим размером органов, более высоким содержанием жировой ткани по сравнению с мужчинами. Различия в уровне гормонов у мужчин и женщин могут влиять на всасывание и элиминацию лекарств. Менопауза может стать причиной изменения фармакокинетики лекарственных средств вследствие не только изменений концентрации эстрадиола, но и увеличения объема жидкости в организме. Доказано, что эстрогены и прогестины вступают во взаимодействие со многими лекарствами, применяемыми при сердечно-сосудистых заболеваниях. Половые различия существуют и в элиминации лекарственных средств, поскольку скорость клубочковой фильтрации у женщин ниже, чем у мужчин, даже после поправки на площадь поверхности тела. У женщин существует также более высокий риск некоторых специфических нежелательных реакций.
При лечении АГ у женщин постменопаузального периода следует отдавать предпочтение антигипертензивным препаратам, которые не оказывают отрицательного метаболического действия и/или способствуют нормализации метаболических нарушений. К таким препаратам относят: ингибиторы ангиотензинпревращающего фермента (иАПФ), антагонисты рецепторов ангиотензина (АРА) II, антагонисты кальция (АК) и высокоселективные β-адреноблокаторы (БАБ).
Для устранения рефлекторной тахикардии, повышающей потребность миокарда в кислороде, показано добавление кардиоселективных БАБ и АК длительного действия (верапамил, дилтиазем).
Селективный b-блокатор метопролол преимущественно метаболизируется CYP2D6 [11]. У мужчин выше активность этого фермента и характерен более быстрый его клиренс. Вследствие этого у женщин достоверно выше плазменный уровень метопролола [12, 13]. Его действие усиливается при приеме оральных контрацептивов [13–15]. Плазменная концентрация пропранолола у женщин на 80% выше, чем у мужчин [15]. Более высокий уровень БАБ в плазме у женщин соотносится с более выраженным снижением ЧСС и АД у женщин, чем у мужчин, под их влиянием [12].
Известны гендерспецифические особенности для некоторых блокаторов кальциевых каналов [16–18]. Эти лекарственные вещества подвергаются первичному метаболизму при прохождении через печень и являются субстратами для CYP3А4, активность которого у женщин выше, чем у мужчин [19–21]. Соответственно, у женщин более высокий клиренс и ниже сывороточная концентрация блокаторов кальциевых каналов, например нифедипина, чем у мужчин [18]. У женщин также выше клиренс верапамила при в/в введении. Клиренс верапамила у женщин с возрастом замедляется. Это объясняет, почему у пожилых женщин (старше 60 лет) снижение АД под его влиянием более эффективно, чем у молодых (от 20 до 30 лет) [22]. В исследовании АССТ установлено, что при терапии амлодипином снижение АД более выраженное у женщин, чем у мужчин [23].
Активность ангиотензинпревращающего фермента — точки приложения иАПФ — у женщин в пременопаузе ниже, чем в постменопаузе [24].
При сопутствующей дисфункции ЛЖ и СН препаратами выбора являются иАПФ, АРА.
Механизмы действия иАПФ при хронической сердечной недостаточности (ХСН):
- ослабление нейрогуморальных вазоконстрикторного и антидиуретического звеньев, усиление вазодилатирующего компонента патогенеза ХСН;
- расширение периферических сосудов, снижение преднагрузки и постнагрузки на сердце;
- уменьшение дилатации камер сердца, регресс гипертрофии миокарда (замедление процесса ремоделирования сердца);
- увеличение сократительной способности миокарда и сердечного выброса;
- улучшение диастолического наполнения желудочков;
- диуретическое и нефропротективное действие;
- снижение клубочковой гипертензии;
- предотвращение электролитного дисбаланса и опосредованного антиаритмического эффекта;
- улучшение функции эндотелия и антиишемического эффекта.
При назначении иАПФ:
- следует избегать одновременного назначения препаратов, дополнительно снижающих АД (АК, БАБ, нитратов);
- отменить нестероидные противовоспалительные препараты;
- прекратить прием диуретиков;
- отменить психотропные препараты (хлорпромазин, тиоридазин и др.);
- ступенчатое титрование дозы (каждые 5–7 дней).
Дозировки иАПФ представлены в таблице 1.

Для купирования гипертонического криза используют гипотензивные препараты короткого и среднего действия — иАПФ, АРА, БАБ с внутренней симпатомиметической активностью, препараты центрального действия (клонидин, празозин и др.). При гипертонических кризах, протекающих с явлениями СН, препаратами выбора являются нитраты. Следует избегать быстрого и чрезмерного снижения АД (<100/70 мм рт. ст.), т. к. это может спровоцировать тахикардию, усиление ишемии миокарда.
M. Hudson et al. изучали в течение 5 лет результаты лечения ЗСН, в т. ч. сочетание АГ и ХСН, с использованием АРА и иАПФ у мужчин и женщин. В исследовании приняли участие 10 223 женщины (8627 принимали иАПФ, 1956 — АРА) и 9475 мужчин (8484 принимали иАПФ, 991 — АРА). Было отмечено, что 3-месячная выживаемость значительно выше в группе женщин, принимавших АРА, чем в группе принимавших иАПФ, а также выше, чем у мужчин обеих групп [26].
Механизм действия АРА:
- подавление активности РААС на уровне клеточных рецепторов;
- ослабление эффектов ангиотензина (АТ) II;
- не подавляется активность киназы II, разрушающей брадикинин (отсутствие побочных явлений — бронхоспазма, кашля);
- подавление активности только РААС;
- широкий спектр действия, высокая селективность (обязательный контроль уровней АД, калия, креатинина).

Дозировки АРА приведены в таблице 2. Сравнение эффектов иАПФ и АРА отображено в таблице 3.
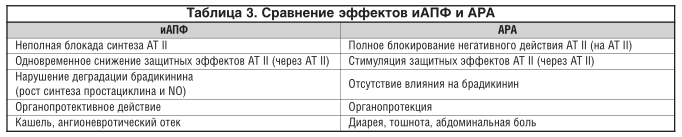
Нам видится, что большая эффективность АРА наблюдается в женской популяции с АГ. АРА II целесообразно применять при плохой переносимости иАПФ [27, 28]. Представители класса АРА могут различаться между собой степенью сродства к АТ1-рецепторам за счет имеющихся различий в модели взаимодействия с рецепторами.
Сравнивалась антигипертензивная активность олмесартана медоксомила с другими сартанами — лозартаном, валсартаном и ирбесартаном [29]. Через 8 нед. лечения снижение уровней САД и ДАД при терапии олмесартана медоксомилом было достоверно больше, чем при приеме лозартана, валсартана и ирбесартана.
В исследовании S. Nakayama et al. сравнивалось влияние олмесартана медоксомила в дозе 20 мг с телмисартаном в дозе 40 мг на повышенные уровни АД у пациентов с СД 2-го типа [30]. Через 8 нед. при терапии олмесартаном было отмечено достоверно большее снижение «офисных» уровней АД и по данным суточного мониторирования АД.
В двойном слепом рандомизированном исследовании MARAVEL, в котором сравнивали прием ирбесартана в дозе 150–300 мг/сут и эналаприла 10–20 мг/сут, оба препарата снижали АД до целевых значений (128,8 и 79,9 мм рт. ст. в группе ирбесартана и 127,2 и 80,5 мм рт. ст. — в группе эналаприла). Однако частота, вероятно, связанных с лечением побочных эффектов составила всего 9,2% в группе ирбесартана в сравнении с 24,6% в группе эналаприла [31].
Немаловажен нефропротективный эффект БРА при диабетической нефропатии и микроальбуминурии, протеинурии (класс I, уровень доказательности В). Например, в исследовании IDNT у пациентов с АГ и диабетической нефропатией риск удвоения креатинина на 37% ниже в группе ирбесартана (р<0,001) в сравнении с группой, принимающей амлодипин. Кроме того, относительный риск развития терминальной стадии почечной недостаточности был на 23% ниже в группе ирбесартана [32].
Важное место в лечении, наряду с иАПФ и АРА, также занимают агонисты J1-имидазолиновых рецепторов, обладающие положительным гипотензивным эффектом и повышающие чувствительность тканей к инсулину; они вызывают эффекты торможения гиперактивности САС, приводящие к снижению АД и уменьшению ЧСС, способствуют снижению уровня холестерина липопротеинов низкой плотности, толерантности к глюкозе.
Женщины в постменопаузе являются более солечувствительными, чем мужчины. У большинства женщин в постменопаузе имеется объем-зависимый тип АГ с наличием сопутствующих метаболических нарушений. В таких случаях эффективен тиазидоподобный диуретик индапамид. Он способствует снижению АД, воздействует на сосудистый тонус и водно-электролитный баланс, обладает кардиопротективными свойствами, не нарушает углеводный и липидный обмен.
Биодоступность ацетилсалициловой кислоты (АСК) у женщин выше, чем у мужчин благодаря более медленному клиренсу и достоверно более длительному периоду полувыведения [33]. Благоприятные эффекты приема АСК или клопидогрела для женщин и мужчин доказаны при вторичной профилактике кардиоваскулярных заболеваний.
Важных различий в плазменной концентрации клопидогрела и его активных метаболитов у женщин не обнаружено. По данным исследований (CURE, CREDO, CLARITY-TIMI 28), гендерных особенностей в протективном эффекте клопидогрела не выявлено, но частота кровотечений у женщин выше [34].
Несмотря на возросший интерес к проблеме женского здоровья, остается много нерешенных вопросов, что связано с недостаточным числом клинических исследований и наблюдений, необходимых для разработки алгоритмов диагностики сердечно-сосудистых заболеваний у женщин, понимания гендерной фармакологии и стратификации риска кардиоваскулярных событий в женской популяции.
Таким образом, выявленные особенности патогенеза и клинического течения АГ у женщин должны обязательно отражаться на принципах фармакотерапии с целью снижения риска кардиоваскулярных событий. Раннее назначение комбинированной антигипертензивной терапии, использование АРА, обладающих эндотелийпротективным и нефропротективным действием, способствует предупреждению прогрессирования АГ и уменьшению сердечно-сосудистых осложнений в женской популяции.
Источник
Введение
Сахарный диабет (СД) признан экспертами ВОЗ неинфекционной эпидемией и представляет собой серьезную медико-социальную проблему. В 2010 г. СД страдало около 6,4% (285 млн) жителей планеты. К 2030 г. ожидается увеличение количества больных до 7,7% (439 млн человек) [1]. Ишемическая болезнь сердца (ИБС) является основной причиной смерти больных СД [2], причем 90% этих больных страдает СД 2 типа (СД 2) [3].
Наличие СД сопряжено с возникновением всех форм ИБС — стенокардии, безболевой ишемии миокарда (БИМ), инфаркта миокарда (ИМ), внезапной сердечной смерти [4]. При этом макрососудистые осложнения, включая ИБС, инсульт, заболевания периферических сосудов, являются причиной смертности больных СД в 67% случаев [5]. Основываясь на имеющихся данных, можно рассматривать СД как своеобразное ССЗ [6]. В 50% случаев повышение риска развития сердечно-сосудистых поражений при СД 2 объясняется большей частотой и выраженностью традиционных факторов риска у больных СД [7]. Факторами риска у больных СД считаются: дислипидемия, артериальная гипертензия (АГ), курение, наследственная предрасположенность по ИБС, наличие микро- и макроальбуминурии.
Сахарный диабет и нарушения липидного обмена
Изучение особенностей распространенности, методов диагностики и лечения дислипидемии представляет особый интерес у больных СД. Сведения о распространенности дислипидемии у пациентов с СД 2 представлены в таблице 1 [8].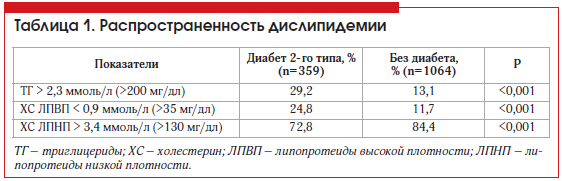
Следует особо отметить гипертриглицеридемию (ГТ) и уменьшение уровня холестерина (ХС) липопротеидов высокой плотности (ЛПВП) [10, 11]. У больных СД 2 выделяют гиперпродукцию «малых, плотных» липопротеидов низкой плотности (ЛПНП) [12]. При этом 69% больных СД имеют нарушения липидного обмена [13]. Атерогенное действие дислипидемии усиливается при присоединении диабетических нарушений углеводного обмена. Для больных, страдающих СД, наиболее характерна следующая липидная триада при СД: гипертриглицеридемия, увеличение процентного содержания «малых, плотных» ЛПНП, снижение концентрации ЛПВП. Данные изменения липидного спектра способствуют развитию атеросклероза независимо от повышения уровня общего ХС и общей фракции ХС ЛПНП.
Учитывая важную роль триглицеридов (ТГ) в развитии дислипидемии при СД 2, приводим классификацию уровней ТГ в сыворотке крови (табл. 2) [14]. 
Большое значение в развитии раннего коронарного атеросклероза имеет специфическое нарушение липидного обмена у больных СД 2 – диабетическая дислипидемия.
Сахарный диабет, ишемическая болезнь сердца и артериальная гипертония
Эпидемиологические данные свидетельствуют о существовании достоверной связи между уровнем гликозилированного гемоглобина и риском сердечно-сосудистой заболеваемости и смертности. При увеличении уровня гликозилированного гемоглобина на 1% риск развития ССЗ возрастает на 10% [15].
Инсулинорезистентность также играет важнейшую роль в патогенезе СД 2. Гиперинсулинемия тесно связана с метаболическим синдромом, который включает в себя инсулинорезистентность, АГ и ожирение и сопровождается высоким риском ССО.
Изменение концентрации липидов плазмы крови при СД 2 является предиктором ИБС. Установлено, что у лиц с высоким уровнем глюкозы в крови натощак и после нагрузки отмечается достоверно более высокая смертность от ССЗ [16]. Бессимптомная гипергликемия, особенно у женщин, является существенным фактором риска развития ИБС [17].
Влияние гиперинсулинемии и инсулинорезистентности на развитие атеросклероза связано с воздействием на процессы свертывания крови [18]. Отмечаются гиперкоагуляция и депрессия фибринолиза, что может способствовать внутрикоронарному тромбозу. У пациентов с СД 2 выявляется повреждение эндотелия и его дисфункция, что является дополнительным фактором повышенного риска развития ИБС.
Основная причина смертности больных СД – ССО, составляющие до 80%. Смертность от ИМ среди больных СД составляет 39% [19], от инсульта – превышает таковую у лиц без диабета [5]. При сочетании АГ и СД в 2–4 раза возрастает риск развития ИБС, что прямо коррелирует с длительностью СД [20]. АГ обнаруживается у 20–60% больных СД 2, она встречается в 1,5 раза чаще, чем у лиц без СД. Наличие АГ при СД увеличивает риск макрососудистых (ИБС, СН, инсульт) и микрососудистых (диабетическая ретинопатия, нефропатия) осложнений [21]. Важным является тот факт, что у больных АГ и СД преимущества антигипертензивной терапии более выражены, чем у больных без СД. В связи с этим строгий контроль АД у данной группы больных крайне необходим.
При СД возможно возникновение всех форм ИБС, как болевых, так и, особенно, безболевых. Наличие микроангиопатий и невропатий при СД способствует формированию безболевых вариантов ИБС (безболевые ИМ, атипичные приступы стенокардии), протекающих в форме нарушений сердечного ритма и сердечной недостаточности. У больных СД в 2 раза чаще встречается безболевой ИМ, что связывают с автономной кардиальной невропатией. При СД частой формой ИБС является БИМ. Она заключается в преходящих нарушениях метаболизма, функции, перфузии, электрической активности миокарда, которые не проявляются приступами стенокардии или их эквивалентами.
Клинические особенности ИБС у больных СД следующие:
– одинаковая частота у мужчин и женщин;
– высокая частота безболевых форм ИБС (БИМ, безболевой ИМ);
– частое развитие постинфарктных осложнений;
– смертность в остром (10 дней) и подостром (4–8 нед.) периодах ИМ в 2 раза превышает таковую у лиц без СД.
При наличии СД следует стремиться к возможной ликвидации всех эпизодов ишемии миокарда, а не только к купированию типичных приступов стенокардии (избавление от «общего ишемического бремени» — total ischemic burden). Этого можно достичь путем снижения частоты и продолжительности эпизодов депрессий сегмента ST при холтеровском мониторировании ЭКГ, которое должно шире использоваться у пациентов с СД для оценки эффективности антиишемического лечения.
Сахарный диабет и поражение почек
Наиболее ранний маркер поражения почек при СД – микроальбуминурия, она является предвестником диабетической нефропатии и существенным фактором риска формирования сердечно-сосудистой патологии. Стойкая альбуминурия на уровне 30–299 мг / 24 ч (или микроальбуминурия) служит маркером нефропатии и одновременно маркером риска развития ССО [22].
Сахарный диабет и сердечная недостаточность
Фремингемское исследование достаточно убедительно подтвердило повышение риска развития сердечной недостаточности (СН) у больных СД – у мужчин в 4 раза, у женщин – в 8 раз чаще, чем у лиц без СД. По данным российского исследования ЭПОХА, наличие СН является существенным предиктором развития СД в дальнейшем. В общей популяции распространенность СД составляет 2,9%, а среди больных с СН III–IV ФК – 15,8%. При ХСН наличие инсулин-независимого СД заметно ухудшает прогноз пациентов, особенно женщин (на 45%).
При СД миокард поражается независимо от наличия атеросклероза коронарных артерий (диабетическая кардиомиопатия). Изменения в сосудах сердца проявляются в виде микроангиопатий, нарушается микроциркуляция, отмечаются морфофункциональные изменения миокарда. Нарушается биоэлектрическая активность миокарда, снижается его сократительная способность с тенденцией к развитию декомпенсации кровообращения. При длительном течении СД, особенно 2 типа, атеросклеротические изменения касаются не только магистральных артерий, но и артерий среднего и малого калибра. Также у больных СД 2 выражена гипертрофия миокарда, способствующая нарушению коронарного кровообращения. Прогрессирование гипертрофии и дилатации левого желудочка (ЛЖ) снижает сократительную функцию, происходит напряжение стенок во время систолы, что способствует увеличению потребности миокарда в кислороде и развитию кардиосклероза. При СД нередко развивается гиперкинетический вариант центральной гемодинамики с увеличением объема циркулирующей крови, тахикардией [23].
Диабетическая кардиомиопатия проявляется гипертрофией кардиомиоцитов, миокардиальным фиброзом. Повышенное содержание коллагена в миокарде, гипертрофия ЛЖ приводят к потере эластичности с появлением жесткости, ригидности сердечной мышцы.
Таким образом, снижение сократительной способности миокарда при СД и ИБС обусловлено кардиальными и некардиальными факторами. Диабетическая миокардиодистрофия в своей основе связана с нарушением метаболизма кардиомиоцитов, имеют значение также диабетическая вегетоневропатия и микроангиопатия [24]. Кардиальные нарушения у больных СД 2 характеризуются также нарушением диастолической функции ЛЖ. В формировании поражения сердца при СД принимает участие ряд патогенетических механизмов: макроангиопатия с атеросклерозом коронарных артерий, нарушение метаболизма миокарда, расстройства микроциркуляции в форме диабетической микроангиопатии.
Поражение сердца при СД требует профилактического и лечебного воздействия.
Лечение дислипидемии у больных сахарным диабетом
Коррекция дислипидемии при СД осуществляется по тем же принципам, что и у больных ИБС. Статины являются препаратами первого выбора. При этом не стоит забывать о том, что улучшение прогноза у пациентов с СД, ИБС и СН предполагает обязательный жесткий метаболический контроль за целевыми уровнями глюкозы и АД. Контроль за гликемией является важной основой лечения больных СД. Клинические исследования DCCT [25], UKPDS [26] показали, что улучшение гликемического контроля сопровождается устойчивым снижением риска ретинопатии, нефропатии, а также достоверным снижением риска микрососудистых осложнений на 25% и недостоверной тенденцией к уменьшению риска ИМ на 16%.
Целью гиполипидемической терапии при СД является достижение уровня общего ХС < 4,5 ммоль/л, ХС ЛПНП < 2,6 ммоль/л. Оптимальный уровень ХС ЛПВП – 1,02 ммоль/л у мужчин и > 1,28 ммоль/л у женщин [27], концентрация ТГ < 1,7 ммоль/л. В плане снижения уровня ХС ЛПНП ведущая роль принадлежит статинам; фибраты (фенофибрат, гемфибразил, ципрофибрат и др.) особенно эффективны в уменьшении уровня ТГ и в увеличении уровня ХС ЛПВП. Пациентам со смешанной гиперлипидемией показано назначение комбинированной терапии (статины + фибраты).
По результатам нескольких метаанализов последних лет установлен диабетогенный эффект терапии статинами [28–30], который имеет дозозависимый характер и прямую связь с наличием факторов риска ССЗ. Вопрос о назначении статинов пациентам с СД имеет множество нюансов, требуя индивидуального подхода. Не оставляют сомнений положительные эффекты назначения статинов. У пациентов с СД предпочтение следует отдавать назначению статинов с наиболее выраженным гиполипидемическим эффектом – розувастатину и аторвастатину. Самый крупный метаанализ по оценке влияния снижения уровня ЛПНП на риск развития сердечно-сосудистых событий был выполнен в 2010 г. и включил в себя 26 клинических исследований с участием 170 тыс. пациентов [31]. Среднее время наблюдения составило 5,1 года. Анализ показал, что снижение уровня ЛПНП на 1 ммоль/л приводит к 10-процентному снижению риска общей смерти, 20-процентному снижению риска сердечно-сосудистой смертности, 11-процентному снижению риска сердечно-сосудистых событий. В 2015 г. приняты рекомендации Американской ассоциации по лечению СД (ADA), основные положения которых во многом повторяют положения, изложенные в IAS и ACC/AHA. При назначении терапии статинами учитывают наличие уровня риска ССЗ [32].
Лечение артериальной гипертонии у больных сахарным диабетом
Наиболее часто АГ и ССЗ развиваются на фоне уже существующего СД 2. Такое сочетание несет в себе риск быстрого развития и прогрессирования ССО, характерных как для АГ, так и для СД, поскольку органы-мишени для АГ и СД одни и те же: миокард, венечные артерии, сосуды мозга, почек и сетчатки. При подобном сочетании частота развития ИБС возрастает в 3,5–4 раза, острого нарушения мозгового кровообращения (ОНМК) – в 3 раза, хронической почечной недостаточности (ХПН) – в 30 раз, полной потери зрения вследствие ретинопатии – в 4–5 раз по сравнению с изолированным эффектом AГ.
Развитие АГ при СД 2 связано с активацией механизмов, регулирующих уровень АД, что прежде всего касается гиперактивации симпатической нервной системы (СНС). Под влиянием активации СНС нарушается обмен норадреналина, что приводит к выраженной тканевой гиперсимпатикотонии, симпатической стимуляции сердца, сосудов, почек, способствуя повышению АД.
Контроль уровня АД, по данным Международной федерации диабета (1999), способствует снижению риска ССО у больных СД 2 на 51%.
Целевой уровень АД у больных СД ниже, чем у пациентов без СД – 130/80 мм рт. ст., а при наличии выраженной нефропатии – 125/75 мм рт. ст. При достижении такого уровня удается затормозить прогрессирование сосудистых осложнений при СД. Препаратами первого выбора являются ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II (АРАII). Могут также использоваться медленнодействующие, пролонгированные антагонисты кальция (АК) (амлодипин, нормодипин, лацидипин и др.) и кардиоселективные β-адреноблокаторы (метопролол, карведилол, небиволол, бисопролол и др.).
У пациентов с СД с повышенной активностью СНС и АГ целесообразно применять препараты, снижающие ее активацию, в частности β-адреноблокаторы, которые широко используются при СД 2, особенно при его сочетании с АГ. Следовательно, β-адреноблокаторы, так же как и иАПФ, АРАII, предотвращают развитие кардиальных осложнений при СД 2. Ряд β-адреноблокаторов, имеющих свойства селективных β-адреноблокаторов, обладающих сосудорасширяющей и протективной активностью, показаны для применения у больных СД 2 и АГ. К таким препаратам относятся: бисопролол, небиволол, карведилол и др. Целесообразно также применение у больных СД 2 и АГ комбинации АРАII и антагониста кальция амлодипина.
Важность учета при длительной антигипертензивной терапии метаболических эффектов, и в частности развития СД, подчеркивается в последних европейских рекомендациях по АГ.
Лечение ХСН у больных сахарным диабетом
Патогенез и лечение ХСН у пациентов с СД имеют определенные особенности, которые следует учитывать при проведении рациональной терапии. Лечение СН у больных с СД в основном соответствует общепринятым принципам терапии ХСН. Однако непременной особенностью лечения подобных пациентов является тщательный динамический контроль за основными метаболическими показателями.
Основными средствами лечения СН при СД являются иАПФ и АРАII, эффективность которых превосходит, по данным российского исследования ФАСОН [33, 35], терапию декомпенсации кровообращения у пациентов бeз СД.
В метаанализе (исследование САРРР), посвященном сравнению эффективности иАПФ, β-адреноблокаторов, АК и диуретиков при лечении больных АГ и СД, было показано, что назначение иАПФ и АРАII достоверно снижает риск острого ИМ на 48%, ССО – на 32%.
Приоритетными являются современные кардиоселективные и неселективные β-адреноблокаторы со свойствами непрямых вазадилататоров (метопролол, небиволол, бисопролол, карведилол и др.). Гемодинамические эффекты карведилола заключаются в снижении общего периферического сопротивления сосудов (ОПСС) и преднагрузки, увеличении сердечного выброса без рефлекторной тахикардии. Кроме того, препарат обладает антиоксидантной и антиаритмической активностью, вазопротекторным эффектом. Перечисленные свойства делают карведилол весьма ценным при лечении больных с сочетанием СД и ХСН.
АК снижают частоту и продолжительность БИМ. Предпочтительнее использование вазоселективных и долгодействующих АК (амлодипин, фелодипин и др.), не вызывающих рефлекторную тахикардию, увеличение уровня катехоламинов и проишемический эффект. Кроме того, АК обладают антиатерогенным действием.
Среди диуретиков используются калийсберегающие средства (альдактон, верошпирон), индапамид; осторожно следует назначать петлевые и тиазидные диуретики – под контролем показателей углеводного обмена и уровня калия в крови.
Целесообразно применение метаболических средств – триметазидина и др.
Источник
